
【题目】下列说法不正确的是
A.铜片在稀硫酸和NaNO3混合溶液中可溶解
B.常温常压下,46gNO2和N2O4混合气体共含有3mol原子
C.光纤通讯中制造光纤的基本原料是SiO2
D.光照氯水有气泡,逸出该气体是Cl2
科目:高中化学 来源: 题型:
【题目】已知醋酸在水溶液中建立如下电离平衡: CH3COOH![]() H++ CH3COO-,若只改变一个条件,一定可以使c(CH3COOH)/c(H+)减小的是
H++ CH3COO-,若只改变一个条件,一定可以使c(CH3COOH)/c(H+)减小的是
A. 通氯化氢气体 B. 加入少量醋酸钾固体
C. 加入少量氢氧化钠固体 D. 通入少量冰醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.不可将水直接倒入浓硫酸中进行稀释
B.浓硫酸可用于干燥O2、CO2
C.硝酸与铁反应可产生H2
D.浓硫酸对皮肤或衣服有很强的腐蚀性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: Mg能在NO2中燃烧,可能产物为Mg3N2、MgO和N2。Mg3N2容易与水反应。
(1) 某实验探究小组探究Mg与NO2反应的固体产物成分,对固体产物提出三种假设:
I.假设为: 固体产物为MgO;II.假设为:________;III.假设为: ________。
(2) 该小组通过如下实验装置来验证Mg在NO2中燃烧反应产物(夹持装置省略,部分仪器可重复使用
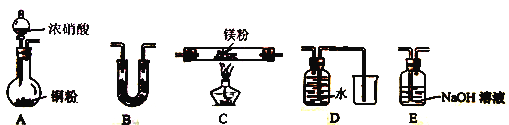
①实验装置连接的顺序为____________(填字母序号);
②装置B中盛装的试剂可以是_______ (填字母)
a.浓硫酸 b.碱石灰 c.无水CaCl2 d.五氧化二磷
③确定产物中有N2生成的实验现象为_____________________。
(3)设计实验证明: 产物中存在Mg3N2: ____________________。
(4)己知装置C中初始加入Mg粉质量为13.2g,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为21.0g,产生N2的体积为1120mL(标准状况)。写出玻璃管中发生反应的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 27gAl与NaOH完全反应,转移的电子数为0.1NA
B. 1L0.1mol/LNaHCO3溶液中,HCO3-的数量为0.1NA
C. 标准状况下,11.2L乙烷中含有的共用电子对数目为3NA
D. 0.1mol18O中含有的中子数为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置进行中和热的测定,请回答下列问题:
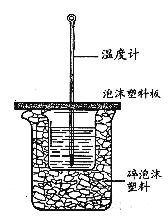
(1)大小烧杯之间填满碎泡沫塑料的作用是___________,做1次完整的中和热测定实验,温度计需使用________次,从实验装置上看,图中缺少的一种玻璃仪器是______________ 。
(2)使用补全仪器后的装置进行实验,取50mL0.25mol/LH2SO4溶液与 50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的比热容c为 4.18J/ (g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H= ______ , H2SO4与NaOH反应的热化学方程式_______________ 。
(3)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量___________ (填“相等”、“不相等”),所求中和热___________(填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会_______。(填“偏大”、“偏小”、“不受影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙硼烷(B2H6)碱性燃料电池是一种新型电池,具有能量转化效率高、无污染等优点,其结构示意图如图所示。下列说法中不正确的是( )
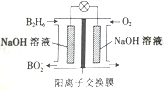
A. 正极的电极反应式为O2+4e-+2H2O=4OH- B. 电池工作时,Na+通过阳离子交换膜向右移动
C. 转移6mol电子理论上消耗乙硼烷的质量为14g D. 消耗1molB2H6时负极参与反应的n(OH-)为12mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂。工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:
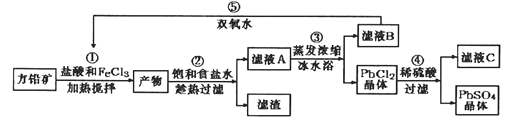
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5。
②PbCl2(s)+2C1-(aq) ![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7。
(1)①中生成淡黄色沉淀的离子方程式是________________________________________________,加入盐酸控制溶液的pH在0.5-1.0之间,主要目的是____________________。
(2)用化学平衡移动的原理解释③中使用冰水浴的原因是__________________
(3)上述流程中可循环利用的物质有_______________。
(4)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。各形态的铅浓度分数x与溶液pH变化的关系如图所示:
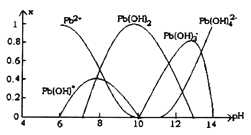
①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为________________。
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的痕量铅和其他杂质离子,实验结果记录如下:
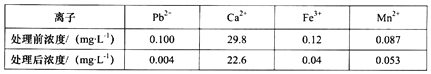
由表可知该试剂去除Pb2+的效果最好,请结合表中有关数据说明去除Pb2+比Fe3+效果好的理由是_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com