
| A. | 植物光合作用:光能→生物质能 | B. | 太阳能热水器:太阳能→电能 | ||
| C. | 石灰石高温分解:热能→化学能 | D. | 铅蓄电池:化学能→电能 |
科目:高中化学 来源: 题型:解答题
 .
. .
. .
. 、
、 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X元素的核外电子数为288 | |
| B. | 核素${\;}_{115}^{288}$X的质量数与中子数之差为173 | |
| C. | 113号元素属于非金属元素 | |
| D. | 115号元素的最高正化合价是+5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①②③ | B. | ②③ | C. | ②④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}Br$ | |
| C. | 硫离子的结构示意图: | |
| D. | NH3 的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
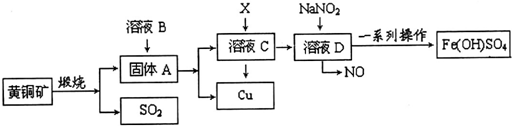

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
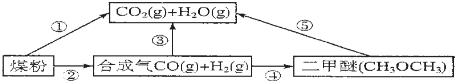
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com