
| A. | ②③ | B. | ②④ | C. | ①③ | D. | ①④ |
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | CuFeS2既是氧化剂又是还原剂,硫元素既被氧化又被还原 | |
| B. | 每生成1molSO2转移6mol电子 | |
| C. | SO2既是氧化产物又是还原产物,FeS只是还原产物 | |
| D. | 每转移1.2 mol电子,有0.3 mol氧气被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,将m1克锌加入到m2克20%的盐酸中放出nLH2,则转移电子数为$\frac{n{N}_{A}}{11.2}$ | |
| B. | 0.1mol/L的100mL H2SO3溶液中,含有的离子数约为0.03NA | |
| C. | 9gD2O中含有的电子数为5NA | |
| D. | 120g由NaHSO4和KHSO3组成的混合物中共含有3NA的阴阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
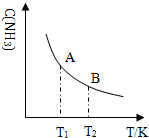
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④② | B. | ②④②③① | C. | ④②③①② | D. | ②④①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的Na2CO3和NaHCO3 | B. | 等物质的量的Al和CaCO3 | ||
| C. | 等质量的Na和Mg | D. | 等质量的Na2CO3和NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com