
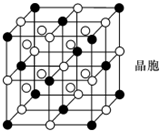
 A,B,C,D,E,F都是短周期元素,原子序数依次增大,B,C同周期且相邻,A,D同主
A,B,C,D,E,F都是短周期元素,原子序数依次增大,B,C同周期且相邻,A,D同主x- 6 |
 表示)位于该正方体的顶点和面心.该化合物的化学式是
表示)位于该正方体的顶点和面心.该化合物的化学式是| 1 |
| 4 |
x- 6 |
| 1 |
| 8 |
| 1 |
| 2 |
| 8 |
| 4 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升温 |
| B、加水 |
| C、加入NaOH溶液 |
| D、加入0.1mol/L HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液氨可用作致冷剂 |
| B、向Fe( OH ) 3 胶体中滴入过量的NaHSO4溶液,能使胶体发生凝聚而沉淀 |
| C、熔融状态下能够导电的化合物中一定存在离子键 |
| D、28g 乙烯和氮气的混合气体中含有NA个原子(戈代表阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2>I2>Fe3+>SO2 |
| B、Cl2>Fe3++>I2>SO2 |
| C、Fe3+>Cl2>I2>SO2 |
| D、Cl2>Fe3+>SO2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硬铝、碳素钢都是合金材料;合成纤维、光导纤维都是有机高分子化合物 |
| B、油脂在碱的作用下可发生水解,工业上利用该反应生产肥皂 |
| C、处理废水时可加入明矾作为混凝剂,以吸附水中的杂质 |
| D、推广可利用太阳能、风能的城市照明系统,发展低碳经济和循环经济,有利于改善环境质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com