
|
��ͼװ�â���һ�ֿɳ���أ�װ�â�Ϊ���أ�װ�â�����ӽ���Ĥֻ����Na+ͨ������֪��س�ŵ�Ļ�ѧ����ʽΪ��2NaS2��NaBr3
| |
| [����] | |
A�� |
�պϿ���Kʱ�������Ӵ��ҵ���ͨ�����ӽ���Ĥ |
B�� |
�պϿ���Kʱ��������ӦʽΪ��3NaBr��2e����NaBr3��2Na+ |
C�� |
�պϿ���Kʱ��X�缫��ӦʽΪ��2Cl����2e����Cl2�� |
D�� |
�պϿ���Kʱ������0.1 mol��Na+ͨ�����ӽ���Ĥ��X�缫��������״��������1.12 L |
 �ǻۿ����ܾ�100�ֵ�Ԫ���ؼ��ϵ�д�
�ǻۿ����ܾ�100�ֵ�Ԫ���ؼ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ɽ��ʡʤ������һ��2012�������ѧ�ڵ�һ�ε��п��Ի�ѧ���� ���ͣ�013
|
��ͼװ��(1)Ϊһ�ֿɳ���ص�ʾ��ͼ�����е����ӽ���Ĥֻ����K+ͨ�����õ�س䡢�ŵ�Ļ�ѧ����ʽΪ2K2S2��KI3
| |
| [����] | |
A�� |
K+���ҵ���ͨ�����ӽ���Ĥ |
B�� |
�缫M�ķ�Ӧʽ��I3����2e����3I�� |
C�� |
�缫X�ķ�Ӧʽ��4OH����4e�� |
D�� |
���缫Y��0.2 mol��e��ת��ʱ������0.1 mol��Cl2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�긣��ʡ����һ�С����и߶���ѧ����ĩ������ѧ�Ծ����������� ���ͣ������
��Դ��ȱ������������ٵ��ش����⣬���û�ѧ��Ӧ��ʵ�ֶ�����ʽ�������ת������ش��������⣺
��1������̬��̬ԭ���γ�1mol��ѧ���ͷŵ���������м��ܡ��ӻ�ѧ���ĽǶȷ�������ѧ��Ӧ�Ĺ��̾��Ǿɼ����Ѻ��¼����γɹ��̡���֪��ӦN2(g)��3H2(g) 2NH3(g) ��H����93 kJ��mol��1���Ը��ݱ������м������ݣ�����a ����ֵΪ_______kJ��mol��
2NH3(g) ��H����93 kJ��mol��1���Ը��ݱ������м������ݣ�����a ����ֵΪ_______kJ��mol��
| ��ѧ�� | H��H | N��H | N��N |
| ����/kJ��mol��1 | 436 | a | 945 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ���㽭ʡ������ѧ�����п��Ի�ѧ�� ���ͣ������
��Դ��ȱ���������ٵ��ش����⡣�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
(1)��ҵ��һ������������ַ�Ӧ�ϳɼ״���
��ӦI��CO2(g)+3H2(g)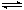 CH3OH(g)+H2O(g)
��H1
CH3OH(g)+H2O(g)
��H1
��ӦII��CO(g)+2H2(g)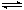 CH3OH(g) ��H2
CH3OH(g) ��H2
�ٷ�ӦI��ƽ�ⳣ������ʽΪK=________________________
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)
|
�¶� |
250�� |
300�� |
350�� |
|
K |
2.041 |
0.270 |
0.012 |
�ɱ��������жϦ�H2________0����S______0 (�������������������)��
�۶��ڷ�ӦII���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���__________��
A�������¶� B����CH3OH(g)����ϵ�з���
C������He��ʹ��ϵ��ѹǿ���� D����ԭ�����ٳ��� CO�� H2
��ij�¶��£���2 mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)=0.2 mol��L-1����CO��ת����Ϊ________����ʱ���¶�Ϊ_______(���ϱ���ѡ��)��
(2)��֪�ڳ��³�ѹ�£�
�� 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ��H ��-1275.6 kJ��mol-1
�� 2CO(g)+O2(g)��2CO2(g) ��H ��-566.0 kJ��mol-1
�� H2O(g)��H2O(l) ��H��-44.0 kJ��mol-1д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ____________________��
(3)ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ�����������ͼ��ʾ�ĵ��װ�á�
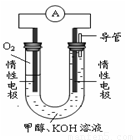
�ٸõ����OH-��_______���ƶ�(���������)
�ڸõ�ظ����ĵ缫��ӦΪ_________________________��
���øõ�ص��(���Ե缫)500mLijCuSO4��Һ�����һ��ʱ���Ϊʹ�������Һ�ָ���ԭ״̬����Ҫ����Һ�м���9.8g Cu(OH)2���塣��ԭCuSO4��Һ�����ʵ���Ũ��Ϊ_______________�����������ռ�����״���µ��������Ϊ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ͬ���� ���ͣ�������ѡ����
 K2S4 +3KI��װ��(��)Ϊ���ص�ʾ��ͼ�����պϿ���Kʱ��X������Һ�ȱ�졣������˵����ȷ����
K2S4 +3KI��װ��(��)Ϊ���ص�ʾ��ͼ�����պϿ���Kʱ��X������Һ�ȱ�졣������˵����ȷ���� 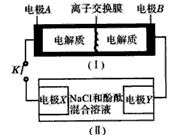
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com