
【题目】下列关于有机物的说法正确的是
A.涤纶、纤维素、酚醛树脂都是合成材料
B.汽油和植物油都是混合物,主要成份是烃和酯
C.甲酸与乙酸是有机酸,都不能被酸性高锰酸钾溶液氧化
D.葡萄糖、蔗糖、淀粉在一定条件下都可发生水解反应
科目:高中化学 来源: 题型:
【题目】如图为元素周期表的一部分,已知A、B、C、D均为短周期元素,A与D的原子序数之和是C的原子序数的1.5倍。
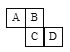
(1)A、B、C、D的简单气态氢化物中最不稳定的是__________(写化学式)。
(2)A、D两种元素的简单气态氢化物相互反应的化学方程式为___________________,现象为___________;产物的电子式为____________。
(3)写出下列物质的电子式:D的气态氢化物______________。A的单质_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们的衣食住行中都蕴含着丰富的化学知识,下列说法中正确的是( )
A.衣料中的蚕丝和涤纶都属于合成有机高分子材料
B.加碘食盐和铁强化酱油都可以补充人体必需的微量元素
C.建筑高楼大厦时用到的钢是纯净物
D.用液化石油气代替汽油作汽车燃料,不会造成空气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6 L的气体。该合金中铝、铁的物质的量之比为( )
A. 1∶1 B. 2∶5 C. 3∶2 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于A1及其化合物的说法正确的是
A.AlO3不能与水反应生成Al(OH)3
B.铝是人类使用最早的金属
C.实验室常用AlCl3溶液和NaOH溶液制备Al(OH)3
D.Al制容器可以长期盛放酸性、碱性和咸的食物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,烧瓶中充满a气体,滴管和烧杯中盛放足量b溶液,将滴管中溶液挤入烧瓶,打开止水夹f,能形成喷泉的是( )
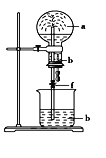
A. a是Cl2,b是饱和NaCl溶液
B. a是NO,b是H2O
C. a是 NH3,b是稀盐酸溶液
D. a是CO2,b是H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是元素周期表的一部分,回答下列有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
4 |
|
|
(1)与水反应最剧烈的金属元素是_____;元素构成的最稳定气态氢化物的化学式是_________;③、④、⑧元素原子半径由大到小是_____________(用元素符号表示).
(2)写出元素⑦的单质与⑥最高价氧化物的水化物反应的离子方程式______________.
(3)②、④两种元素形成某气体化合物是导致温室效应的主要原因,该化合物的电子式为_____________;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程______________________.
(4)②的单质与⑨的最高价氧化物的水化物的浓溶液反应化学方程式____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研单位利用电化学原理用SO2来制备硫酸,装置如下图,含有某种催化剂。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
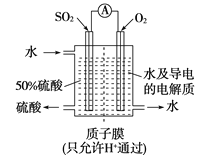
(1)通入SO2的电极为__________极,其电极反应式为_________________,此电极区pH_______(填“增大”“减小”或“不变”)。
(2)若通入SO2的速率为2.24 L/min(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率是 (结果用 mL/min表示)
(3)以此电源电解足量的硝酸银溶液,若阴极产物的质量为21.6 g,则阳极产生气体标准状况下体积为__________L。
(4)常温时,BaSO4的Ksp=1.08×10-10。现将等体积的BaCl2溶液与3.5×10-3mol/L的Na2SO4溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小浓度为________。
(5)已知:Fe2O3(s)+3C(石墨)==2Fe(s)+3CO(g) ΔH =+489.0 kJ·mol-1
CO(g)+1/2O2(g)==CO2(g) ΔH=-283.0 kJ·mol-1
C(石墨)+O2(g)==CO2 (g) ΔH=-393.5 kJ·mol-1
则4Fe(s)+3O2(g)==2Fe2O3(s)的ΔH为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】在研究金矿床物质组分的过程中,通过分析发现了Cu-Ni-Zn-Sn-Fe多金属互化物。
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于 (填“晶体”或“非晶体”),可通过 方法鉴别。
(2)基态Ni2+的核外电子排布式 ;配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO FeO(填“<”或“>”)。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为 ;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H—S—C≡N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是 ;写出一种与SCN—互为等电子体的分子 (用化学式表示)。
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为 。
![]()
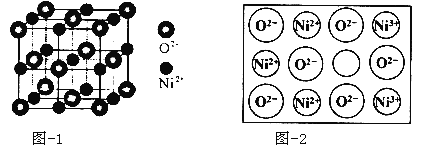
(5)立方NiO(氧化镍)晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为 g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)。人工制备的NiO晶体中常存在缺陷(如图):一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com