
| A. | 水的电离程度:①<② | |
| B. | ①、②中粒子浓度关系均符合:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| C. | 将③、④混合,所得溶液的pH>7,则该溶液中:c(NH4+)=c(NH3•H2O) | |
| D. | 向③、④中分别加入25mL0.1mol•L-1盐酸后,溶液中c(NH4+):③=④ |
分析 A.两溶液都促进了水的电离,水解程度越大,水的电离程度越大;
B.溶液中一定满足电荷守恒,根据电荷守恒判断;
C.③氨水、④NH4Cl混合后溶液呈碱性,说明一水合氨的电离程度大于铵根离子的水解程度;
D.加入等体积、等浓度的盐酸后,③为氯化铵溶液,④为氯化铵和氯化氢的混合液,④中氯化氢抑制了铵根离子的水解.
解答 解:A.Na2CO3的水解程度大于NaHCO3,则水的电离程度:①>②,故A错误;
B.①Na2CO3溶液、②NaHCO3溶液中都满足电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故B正确;
C.③、④混合,所得溶液的pH>7,说明一水合氨的电离程度大于铵根离子的水解程度,则该溶液中:c(NH4+)>c(NH3•H2O),故C错误;
D.向③、④中分别加入25mL0.1mol•L-1盐酸后,③为NH4Cl溶液,④为NH4和HCl的混合液,④中HCl电离出的氢离子抑制了NH4+的水解,在溶液中c(NH4+):③<④,故D错误;
故选B.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确电荷守恒、盐的水解原理为解答关键,注意掌握电离平衡及其影响因素,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. | 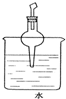 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
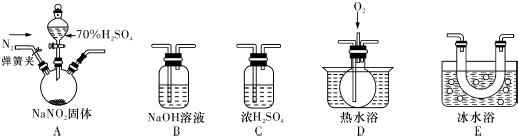
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
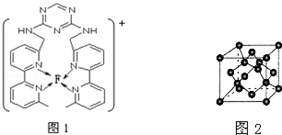
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若两种元素形成XY2型化合物,其中XY2若形成分子晶体,则XY2是非极性分子 | |
| B. | 若两种元素形成YX2型化合物,则YX2既可能形成原子晶体,也可能形成分子晶体 | |
| C. | 若两种元素可形成YX型化合物,则YX的晶体一定属于离子晶体 | |
| D. | 若两种元素可形成YX3型化合物,则YX3的水溶液可能呈强碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:2:3 | B. | 5:2:2 | C. | 9:3:1 | D. | 9:3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com