
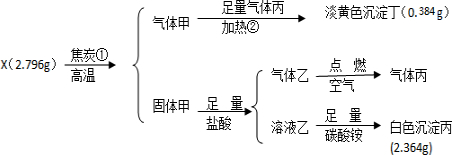
 .
.分析 某难溶物质X与焦炭在隔绝空气条件下加热生成气体甲与固体甲,气体甲与丙反应生成的淡黄色沉淀丁应为S,n(S)=$\frac{0.384g}{32g/mol}$=0.012mol,固体甲中含S元素,盐酸反应生成气体乙为H2S,点燃时H2S燃烧生成气体丙为SO2,溶液乙与碳酸铵反应生成白色沉淀丙可能为BaCO3,n(BaCO3)=$\frac{2.364g}{197g/mol}$=0.012mol,可知X中含Ba、S元素的物质的量为1:1,丙为SO2,则X中含O为$\frac{2.796g-0.384g-0.012mol×137g/mol}{16g/mol}$=0.048mol,可知X中Ba、S、O的原子个数比为1:1:4,即X为BaSO4,以此来解答.
解答 解:某难溶物质X与焦炭在隔绝空气条件下加热生成气体甲与固体甲,气体甲与丙反应生成的淡黄色沉淀丁应为S,n(S)=$\frac{0.384g}{32g/mol}$=0.012mol,固体甲中含S元素,盐酸反应生成气体乙为H2S,点燃时H2S燃烧生成气体丙为SO2,溶液乙与碳酸铵反应生成白色沉淀丙可能为BaCO3,n(BaCO3)=$\frac{2.364g}{197g/mol}$=0.012mol,可知X中含Ba、S元素的物质的量为1:1,丙为SO2,则X中含O为$\frac{2.796g-0.384g-0.012mol×137g/mol}{16g/mol}$=0.048mol,可知X中Ba、S、O的原子个数比为1:1:4,即X为BaSO4,
(1)固体甲中金属元素Ba在周期表中的位置为第六周期、IIA族,气体乙的电子式为 ,
,
故答案为:第六周期、IIA族; ;
;
(2)X的化学式是BaSO4,故答案为:BaSO4;
(3)反应①和反应②的化学方程式分别为BaSO4+4C$\frac{\underline{\;高温\;}}{\;}$BaS+4CO、2CO+SO2$\frac{\underline{\;\;△\;\;}}{\;}$S+2CO2,故答案为:BaSO4+4C$\frac{\underline{\;高温\;}}{\;}$BaS+4CO;2CO+SO2$\frac{\underline{\;\;△\;\;}}{\;}$S+2CO2.
点评 本题考查无机物的推断,为高频考点,把握转化中发生的反应及淡黄色沉淀为S、白色沉淀丙为碳酸钡为解答的关键,侧重分析与推断能力的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小压强 | B. | 降低温度 | ||
| C. | 增大O2浓度 | D. | 使用合适的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ①②④⑤ | C. | ②③ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 1:2:2 | C. | 6:3:2 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80% | B. | 60% | C. | 40% | D. | 20% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作方法 | 实验原理 |
| A | 铁粉中混有少量铝粉:溶于浓氢氧化钠溶液,过滤 | 铝粉与氢氧化钠溶液反应,铁粉不和氢氧化钠溶液反应 |
| B | 氯化亚铁溶液中混有氯化铁:加入足量铜粉,过滤 | 铜能将Fe3+还原成Fe2+,铜与Fe2+不反应 |
| C | 过氧化钠中混有氧化钠:在空气中灼烧固体 | 氧化钠与氧气在加热条件下生成过氧化钠 |
| D | 氯化铝溶液中混有氯化镁:加入足量氢氧化铝,过滤 | 氯化镁水解生成盐酸,盐酸与氢氧化铝反应,促进Mg2+完全水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的摩尔质量为12g | |
| B. | 22.4L氢气的物质的量是1mol | |
| C. | 0.1 mol•L-1的NaHSO4 溶液中,阳离子的数目之和为0.2NA | |
| D. | 1molNaCl约含6.02×1023个Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com