
2- 4 |
| 1 |
| 3 |
| 1 |
| 3 |
| n |
| V |
| 1 |
| 3 |
| 1 |
| 3 |
| 16.8g×56 |
| 64 |
| 7g×1mol |
| 56g |
| 0.125mol |
| 0.5L |
| 1.225mol |
| 0.5L |


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
| A、1:2 | B、2:3 |
| C、3:2 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
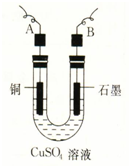 某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如图所示,回答下列问题:
某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“乙醇汽油”的广泛使用能有效减少有害气体的排放 |
| B、向鸡蛋白溶液中缓慢加入饱和(NH4)2SO4溶液有沉淀产生属于物理变化 |
| C、“无氟冰箱”取代“含氟冰箱”,对臭氧层起到了保护作用 |
| D、从油菜籽中提取的生物柴油与从石油炼制得到的柴油都属于烃类物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 气体物质 | 主要来源 | 对环境的影响 | |
| A | 二氧化碳 | 化石燃料的燃烧 | 酸雨 |
| B | 二氧化硫 | 汽车尾气的排放 | 光化学烟雾 |
| C | 二氧化氮 | 工厂废气的排放 | 温室效应 |
| D | 甲醛 | 各类含酚醛树脂胶的人造板装饰材料 | 室内空气污染 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解精炼金属时,含杂质的粗金属做阳极,与电源正极相连 |
| B、电解池中金属导线中电子由电源的负极流向电解池的阳极,从电解池的阴极流向电源的正极 |
| C、在电解池中,电解质溶液中的阴离子向阴极移动,阳离子向阳极移动 |
| D、在电解精炼金属过程中,电解质溶液的成分不发生任何变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4×l0-3 mol/L |
| B、2×l0-3 mol/L |
| C、1×l0-3 mol/L |
| D、1×l0-7 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2 | B、2:5 |
| C、3:7 | D、无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com