
【题目】铅精矿可用于冶炼金属铅,其主要成分为PbS。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
(1)用铅精矿火法炼铅的反应的化学方程式为___________________________。
(2)火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为__________________________________________________。
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:
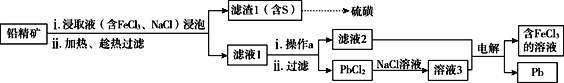
已知:①不同温度下PbCl2的溶解度如下表所示。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
溶解(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
②PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)
PbCl42-(aq)
(3)浸取液中FeCl3的作用是___________________________。
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是____________________________________。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。
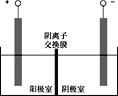
①溶液3应置于_______________(填“阴极室”或“阳极室”)中。
②简述滤液2电解后再生为FeCl3的原理:_____________________。
③若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数的计算式 为_______________。
【答案】 2PbS + 3O2 ![]() 2PbO + 2SO2 2NH3·H2O + SO2
2PbO + 2SO2 2NH3·H2O + SO2 ![]() 2NH4+ + SO32- + H2O 使Pb元素从难溶固体PbS转化成溶液中的PbCl4-,S元素转化成单质硫成为滤渣 加水稀释使PbCl2(aq) + 2Cl-(aq)
2NH4+ + SO32- + H2O 使Pb元素从难溶固体PbS转化成溶液中的PbCl4-,S元素转化成单质硫成为滤渣 加水稀释使PbCl2(aq) + 2Cl-(aq) ![]() PbCl42-(aq)平衡向左移动;温度降低PbCl2溶解度减小 阴极室 阳极发生电极反应:Fe2+ - e-
PbCl42-(aq)平衡向左移动;温度降低PbCl2溶解度减小 阴极室 阳极发生电极反应:Fe2+ - e- ![]() Fe3+(或2Cl- -2e-
Fe3+(或2Cl- -2e- ![]() Cl2;Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-,文字表述也可),使c(Fe3+)升高,同时Cl-通过阴离子交换膜向阳极移动,使FeCl3再生
Cl2;Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-,文字表述也可),使c(Fe3+)升高,同时Cl-通过阴离子交换膜向阳极移动,使FeCl3再生 ![]()
【解析】I.(1)火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2;2PbS + 3O2 ![]() 2PbO + 2SO2;正确答案:2PbS + 3O2
2PbO + 2SO2;正确答案:2PbS + 3O2 ![]() 2PbO + 2SO2。
2PbO + 2SO2。
(2)SO2与过量的氨水反应生成亚硫酸铵,反应的离子方程式为:2NH3·H2O + SO2 ![]() 2NH4+ + SO32- + H2O ;正确答案:2NH3·H2O + SO2
2NH4+ + SO32- + H2O ;正确答案:2NH3·H2O + SO2 ![]() 2NH4+ + SO32- + H2O 。
2NH4+ + SO32- + H2O 。
(3)铁离子具有氧化性,能够把PbS中的Pb氧化为PbCl4-,把S氧化为单质硫;正确答案:使Pb元素从难溶固体PbS转化成溶液中的PbCl4-,S元素转化成单质硫成为滤渣。
(4)加水稀释使PbCl2(aq) + 2Cl-(aq) ![]() PbCl42-(aq)平衡向左移动;温度降低PbCl2溶解度减小,两种操作都有利于PbCl2的析出;正确答案:加水稀释使PbCl2(aq) + 2Cl-(aq)
PbCl42-(aq)平衡向左移动;温度降低PbCl2溶解度减小,两种操作都有利于PbCl2的析出;正确答案:加水稀释使PbCl2(aq) + 2Cl-(aq) ![]() PbCl42-(aq)平衡向左移动;温度降低PbCl2溶解度减小。
PbCl42-(aq)平衡向左移动;温度降低PbCl2溶解度减小。
(5)①根据流程可知溶液3为PbCl42-,滤液2为氯化亚铁溶液,因此溶液3放入阴极室,发生还原反应生成铅;正确答案:阴极室。
②滤液2放入到阳极室,阳极发生电极反应:Fe2+ - e- ![]() Fe3+(或2Cl- -2e-
Fe3+(或2Cl- -2e- ![]() Cl2;Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-),使c(Fe3+)升高,同时Cl-通过阴离子交换膜向阳极移动,使FeCl3再生;正确答案:阳极发生电极反应:Fe2+ - e-
Cl2;Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-),使c(Fe3+)升高,同时Cl-通过阴离子交换膜向阳极移动,使FeCl3再生;正确答案:阳极发生电极反应:Fe2+ - e- ![]() Fe3+(或2Cl- -2e-
Fe3+(或2Cl- -2e- ![]() span> Cl2;Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-,文字表述也可),使c(Fe3+)升高,同时Cl-通过阴离子交换膜向阳极移动,使FeCl3再生。
span> Cl2;Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-,文字表述也可),使c(Fe3+)升高,同时Cl-通过阴离子交换膜向阳极移动,使FeCl3再生。
③根据PbCl42-+2e- ![]() Pb+4Cl- 可知,当电解池中通过c mol电子时,析出金属铅为0.5cmol,根据PbS~Pb关系可知,纯PbS的量为0.5c mol,因此铅精矿中PbS的质量分数的计算式0.5c×239/a×b×100%=
Pb+4Cl- 可知,当电解池中通过c mol电子时,析出金属铅为0.5cmol,根据PbS~Pb关系可知,纯PbS的量为0.5c mol,因此铅精矿中PbS的质量分数的计算式0.5c×239/a×b×100%=![]() ;正确答案:
;正确答案:![]() 。
。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
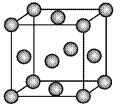
【题目】(1) 如图所示为二维平面晶体示意图,所表示的化学式为AX3的是____。
(2)图为一个金属铜的晶胞,请完成以下各题。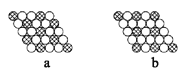
①该晶胞“实际”拥有的铜原子数是____个。
②该晶胞称为____。(填序号)
A.六方晶胞 B.体心立方晶胞 C.面心立方晶胞
③此晶胞立方体的边长为a cm,Cu的相对原子质量为64,金属铜的密度为ρ g·cm-3,则阿伏加德罗常数为________________________(用a、ρ表示,列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物NH3与BF3可以通过配位键形成NH3·BF3。
(1)配位键的形成条件是_________________________________。
(2)在NH3·BF3中,________原子提供孤对电子,________原子接受电子。
(3)写出NH3·BF3的电子式并用“→”标出配位键。______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁可用于牙膏、医药和化妆品等工业,化学式为,Mg(OH)24MgCO35H2O某碱式碳酸镁中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下几个方案:
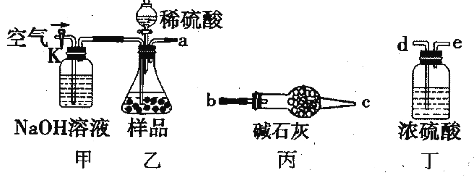
方案Ⅰ
取一定质量的样品,与硫酸充分反应,通过测定生成CO2的质量计算纯度
(1)乙中发生反应的方程式为____________________________。
(2)仪器接口的连接顺序为(装置可以重复使用)a________ ,丁的作用是____________。
(3)关闭止水夹K,向样品中加入足量的稀硫酸,当样品充分反应完后,为了测定准确还应进行的操作是__________________________。
方案Ⅱ
①称取碱式碳酸镁样品m克;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1克。
(4)下列仪器中,该方案不会用到的是______________________。
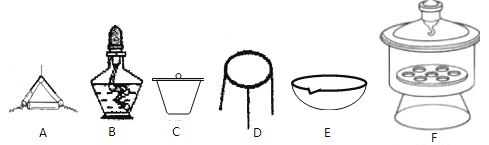
(5)判断样品完全分解的方法是_______________________。
(6)有同学认为方案Ⅱ高温煅烧的过程中会发生MgCO3+SiO2 ![]() MgSiO3+CO2,会导致测定结果有误,你认为这位同学的观点正确吗?________________________(填“正确”或“错误”)请说明自己的理由:_______________________________________________。
MgSiO3+CO2,会导致测定结果有误,你认为这位同学的观点正确吗?________________________(填“正确”或“错误”)请说明自己的理由:_______________________________________________。
(7)求碱式碳酸镁的纯度_______________________(用含有m,m1的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类对原子结构的探究经历了多个历史阶段.下列各阶段的先后顺序正确的是( )
①徳谟克利特提出的古典原子论 ②道尔顿提出的近代原子论
③卢瑟福提出原子结构的“行星模型”④汤姆逊提出原子结构的“葡萄干面包模型”
A.①②③④
B.①②④③
C.①③④②
D.④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是

①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A. ①④⑤ B. ①②③ C. ①③④ D. ①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
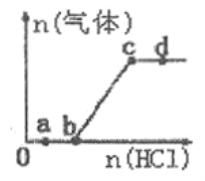
A. a点对应的溶液中:Na+、Ca2+、SO42-、NO3-
B. b点对应的溶液中:K+、Na+、OH-、Cl-
C. c点对应的溶液中: Na+、Ca2+、NO3-、Cl-
D. d点对应的溶液中: Cl-、NO3-、Fe2+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是一些工厂和矿山废水中的污染元素。常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:pKa=-lgKa),下列说法错误的是
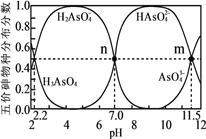
A. Na2HAsO4溶液显碱性
B. H3AsO4溶液pKa2为2.2
C. m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1
D. n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com