
【题目】通过膜电池可除去废水中的乙酸钠和对氯笨酚(![]() ),其原理如下图所示,下列说法正确的是
),其原理如下图所示,下列说法正确的是

A. B为电池的正极,发生还原反应
B. 电流方向从B极沿导线经小灯泡流向A极
C. A极的电极反应式为:![]()
D. 当外电路中有0.2mole-转移时,A极区增加的H+的数目为0.1NA
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为原子序数依次增大的六种元素,位于元素周期表的前四周期。B元素原子含有3个能级,且每个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子。请回答下列问题:
(1)写出D基态原子的价电子排布图__________,F基态原子的外围电子排布式________。
(2)下列说法不正确的是____________(填序号)。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.第一电离能由小到大的顺序:B
C.N2与CO为等电子体,结构相似
D.稳定性:H2O>H2S,水分子更稳定的原因是水分子间存在氢键
(3)F元素位于周期表中_____区,其离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成[F(X)4]2+,该离子的结构式为_____________(用元素符号表示)。
(4)某化合物与F(I)(I表示化合价为+1)结合形成图1所示的离子,该离子中碳原子的杂化方式为_________。
(5)B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子的个数为______。
(6)试从分子的立体构型和原子的电负性、中心原子上的孤电子对等角度解释与D的简单氢化物结构十分相似的OF2的极性很小的原因是____________。
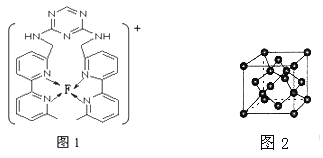
(7)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为apm。F离子的半径bpm,则该晶胞的空间利用率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1×105Pa、298K时,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g) = H2(g) + 1/2O2(g) △H= +242kJ·mol-1
B.2H2(g) + O2(g) = 2H2O(l) △H= +484kJ·mol-1
C.H2(g) + 1/2O2(g) = H2O(g) △H= +242kJ·mol-1
D.2H2(g) + O2(g) = 2H2O(g) △H= +484kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要 0.5mol·L-1 的 NaOH 溶液 480mL,现欲配制此溶液,有以下仪器:①烧杯② 100mL 量筒 ③100mL 容量瓶④胶头滴管⑤玻璃棒⑥托盘天平(带砝码)⑦药匙
(1)配制时,必须使用的仪器有__(填代号),还缺少的仪器是 。该实 验中两次用到玻璃棒,其作用分别是_________________,__________________ 。
(2)配制溶液时,一般可以分为以下几个步骤: ① 称量、②计算、 ③溶解、 ④倒转摇匀、⑤ 转移、⑥洗涤、⑦定容、⑧冷却,其正确的操作顺序为__(用序号填 空),其中在①操作中需称量 NaOH 的质量为______________g。
(3)下列操作结果会使溶液的物质的量浓度偏低的是_________。
A.没有将洗涤液转入容量瓶中
B.称量时用了生锈的砝码
C.定容时,俯视容量瓶的刻度线
D.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度
(4)若某学生用托盘天平称量药品时,在托盘天平左盘放有 20g 砝码,天平达平衡时游码的位置如图,则该同学所称量药品的实际质量为_________g。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于SO2的叙述中,正确的是( )
A.SO2的摩尔质量是64g
B.1molSO2中所含分子数约为6.02×1023
C.1molSO2的质量是64g/mol
D.常温常压下,1mol SO2的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 5.6 g Fe在氧气中燃烧,完全反应时转移电子数为0.3NA
B. 标准状况下,22.4 L氦气与22.4 L氯气所含原子数均为2 NA
C. 32 gCu与S完全反应转移的电子数为0.5NA
D. 1mol O2与足量Na反应,生成Na2O和Na2O2的混合物转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性。将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、9.6、3.7。现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:
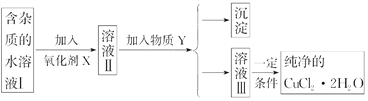
请回答下列问题:
(1)本实验最适合的氧化剂X是________(填序号)。
A.K2Cr2O7 B.NaClO
C.H2O2 D.KMnO4
(2)物质Y是________。
(3)除去Fe3+的有关离子方程式是____________________、_______________________。
(4)加氧化剂的目的是____________________________________________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________,应如何操作?_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. CuCl2溶液蒸干灼烧后得到CuCl2固体
B. 火力发电的目的是使化学能转换为电能
C. 已知C(石墨,s)= C(金刚石,s)△H>0,无法比较二者的稳定性
D. 将FeCl3固体溶于适量蒸馏水来配制FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨的合成是最重要的化工生产之一,工业上合成氨用的H2有多种制取的方法。用天然气跟水蒸气反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
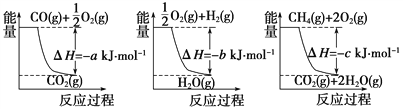
(2)已知通常状况下,每充分燃烧1gCO并恢复到原状态,会释放10KJ的热量。请写出表示CO燃烧热的热化学反应方程式:________________________________。
(3)一种甲烷燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接通入甲烷,同时向一个电极通入空气。此电池的负极电极反应式是_______________。
(4)利用右图装置可以模拟铁的电化学防护。
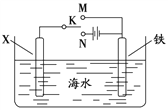
① 若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。假设海水中只有NaCl溶质,写出此时总离子反应方程式:__________________________________________。
② 若X为锌,开关K置于M处,该电化学防护法称为_________。写出铁电极处的电极反应式:_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com