
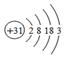
 ,下列关系不正确的是( )
,下列关系不正确的是( )| A. | 原子半径:K>Ga>Al | B. | 碱性:KOH>Ga(OH)3>Al(OH)3 | ||
| C. | 离子的氧化性:K+>Ga3+>Al3+ | D. | 与水反应的剧烈程度:K>Ga>Al |
分析 由原子结构示意图可知Ga位于周期表第四周期ⅢA族,在元素周期表中,同主族元素从上到下金属性逐渐增强,同周期元素从左到右金属性逐渐减弱,以此解答该题.
解答 解:同主族元素从上到下金属性逐渐增强,同周期元素从左到右金属性逐渐减弱,则金属性K>Ga>Al,
A.因同周期元素从做到到右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则K>Ga>Al,故A正确;
B.金属性K>Ga>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故B正确;
C.金属性K>Ga>Al,元素的金属性越强,对应阳离子的氧化性越弱,故C错误;
D.金属性K>Ga>Al,元素的金属性越强,与水反应越剧烈,故D正确.
故选C.
点评 本题考查原子结构与元素周期率,为高频考点,侧重考查学生的分析能力,注意把握元素周期率的递变规律,为解答该题的关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为Fe3+具有氧化性,所以可以用KSCN溶液检验Fe3+ | |
| B. | 将FeCl3饱和溶液滴入NaOH溶液中可制备Fe(OH)3胶体 | |
| C. | FeCl2溶液蒸干灼烧后得到FeCl2固体 | |
| D. | Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液显红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体颜色变浅 | B. | 逆反应速率加快 | ||
| C. | NO2转化率增大 | D. | 气体平均分子量变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低碳生活就是倡导低污染,低消耗,减少温室气体的排放 | |
| B. | 食用醋、医疗酒精、肥皂水三种溶液的pH逐渐增大 | |
| C. | 用活性炭为糖浆脱色和用臭氧漂白纸浆,二者所用原理相同 | |
| D. | 久置的植物油会严生难闻的特殊气味,是由于植物油发生了变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径:X>Y,离子半径:X3+>Y2- | |
| C. | 同族元素中Y的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
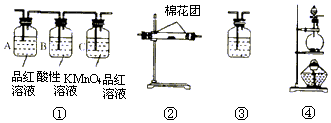 (1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式,并标出电子转移关系
(1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式,并标出电子转移关系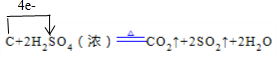 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com