
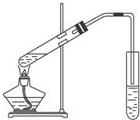
 (A)如图为实验室用CH3COOH与CH3CH218OH制备乙酸乙酯的装置.
(A)如图为实验室用CH3COOH与CH3CH218OH制备乙酸乙酯的装置.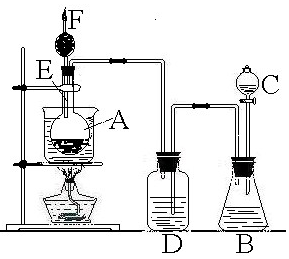
分析 (A)(1)根据导管伸入液面下可能发生倒吸分析;
(2)浓硫酸起到了催化作用和吸水作用;
(3)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
(4)酯化反应的本质为酸脱羟基,醇脱氢;
(B)将C中浓H2SO4滴入B中浓盐酸中,由于浓H2SO4有吸水性,且溶于水要放出大量的热,故B中逸出HCl(g),经D中浓H2SO4干燥,进入A中,HCl溶于C2H5OH中,二者发生反应:C2H5OH+HCl$\stackrel{△}{→}$C2H5Cl+H2O,CuSO4吸收水分变为蓝矾,促使上列反应向右进行,加热时,生成的C2H5Cl从F处逸出,以此解答该题.
解答 解:(A)(1)导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸,
故答案为:防止倒吸.
(1)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂,
故答案为:吸水剂;催化剂;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;
故答案为:中和乙酸、溶解乙醇;降低乙酸乙酯的溶解度,有利于分层;
(4)实验中用乙醇与乙酸作用,酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,反应方程式为:CH3CH218OH+CH3COOH$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O,
故答案为:CH3CH218OH+CH3COOH$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O;
B.(1)浓盐酸在浓硫酸作用下,由于浓H2SO4有吸水性,且溶于水要放出大量的热,可促使盐酸的挥发,生成氯化氢气体,
故答案为:氯化氢;
(2)D中为浓硫酸,进入D中的气体为氯化氢,浓硫酸可起到吸收氯化氢气体中混有的水蒸气的作用,
故答案为:吸收氯化氢气体中混有的水蒸气;
(3)E导管较长,可起到冷凝回流的作用,故答案为:冷凝乙醇蒸气;
(4)点燃火焰呈绿色,说明F出燃烧的气体为CH3CH2Cl,故答案为:CH3CH2Cl;
(5)A瓶中无水硫酸铜变蓝,说明反应有水生成,即氯化氢与乙醇发生取代反应生成水,水与无色CuSO4粉末结合生成蓝色的CuSO4晶体,
故答案为:反应产物有H2O生成,水与无色CuSO4粉末结合生成蓝色的CuSO4晶体;
(6)由A中发生的反应事实,可说明生成水和CH3CH2Cl,证明醇分子中的羟基可被氯化氢分子中的氯原子取代,其反应的方程式为:C2H5OH+HCl$\stackrel{△}{→}$C2H5Cl+H2O,A中反应为取代反应,故答案为:取代反应;
(7)A中反应有机物发生消去反应的是乙醇,在浓硫酸条件小加热170°C,反应的化学方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O.
点评 本题考查了物质的性质实验,为高考常见题型,侧重于学生的分析能力和实验能力的考查、乙酸乙酯的制备,题目难度不大,涉及浓硫酸、饱和碳酸钠溶液的作用以及酯化反应的机理,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cu2+、Cl-、SO42- | B. | Na+、HCO3-、Cl-、NO3- | ||
| C. | Na+、SO32-、NO3-、K+ | D. | K+、SO42-、Mg2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
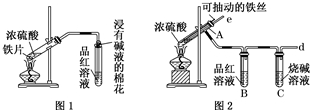 某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验.
某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
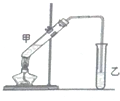 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
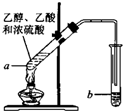 (1)在实验室可使用如图装置制取乙酸乙酯,请回答下列问题:
(1)在实验室可使用如图装置制取乙酸乙酯,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
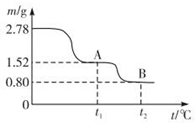
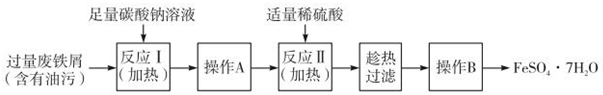
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
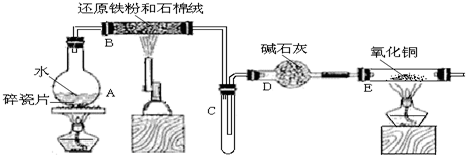
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
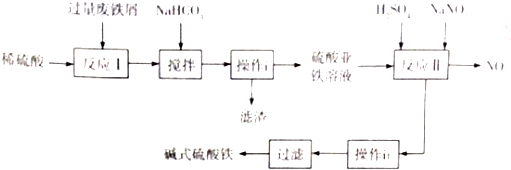
| 沉淀物 | Fe(OH)3 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 7.5 | 3.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com