
| A、1.0L1.0mol?L-1CH3COOH溶液中,CH3COOH分子数为NA |
| B、1 molNa2O2与足量H2O反应转移的电子数NA |
| C、常温常压下,22.4L的D2、H2组成的气体分子数约为NA |
| D、4.6g NO2和N2O4的混合物所含的分子数为NA |
| m |
| M |
| 4.6g |
| 46g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
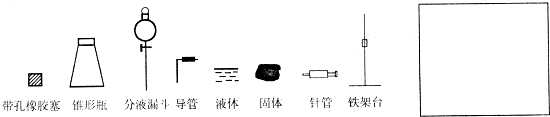
| X Y Z |
0.1g | 0.3g | 0.5g |
| 1.5% | 223g | 67s | 56s |
| 3.0% | 308s | 109s | 98s |
| 4.5% | 395s | 149s | 116s |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中硫酸只表现酸性 |
| B、刺激性气味的气体是氨气 |
| C、红色固体是金属铜 |
| D、1 mol NH4CuSO3完全反应时转移0.5 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、常温时,在c(H+)=
| ||
| B、含大量Fe2+的溶液:Na+、Mg2+、H+、NO3- | ||
| C、含有大量Al3+的溶液:K+、Na+、AlO2-、SO42- | ||
| D、在c(H+)/c(OH-)=1×1013的溶液:NH4+、Mg2+、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol H3PO4能消耗3 NaOH |
| B、10.6 g Na2CO3晶体含有0.1 NA CO32- |
| C、6.4 g Cu被氧化失去的电子数一定为2 NA |
| D、甘油和甲苯的混合液4.6 g含有2.5 NA质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com