
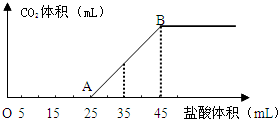
 将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况下测定)关系如图所示:
将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况下测定)关系如图所示:

科目:高中化学 来源: 题型:
| A、醋酸钠的水解:CH3COO-+H2O=CH3COOH+OH- |
| B、碳酸氢钠的水解:HCO3-+H2O?H3O++CO32- |
| C、硫酸氢钠溶液与氢氧化铝反应:H++OH-=H2O |
| D、碳酸氢钾与氢氧化钾溶液反应:HCO3-+OH-=H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | C |
| 第一电离能(kJ?mol-1) | 520 | 496 | 419 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | |
| Z | W |
查看答案和解析>>
科目:高中化学 来源: 题型:
 按如图装置进行实验,并回答下列问题:
按如图装置进行实验,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属氧化物一定是碱性氧化物 |
| B、碱性氧化物一定是金属氧化物 |
| C、非金属氧化物一定是酸性氧化物 |
| D、酸性氧化物一定是非金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金刚石和石墨均为碳元素组成的单质 |
| B、硫酸、纯碱、碳酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| C、蓝矾(CuSO4?5H2O)和干冰属于化合物,铁矿石属于混合物 |
| D、通过化学反应,可由Ba(OH)2一步转化生成NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com