
【题目】单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

相关信息:①四氯化硅遇水极易水解;②SiCl4沸点为57.7℃,熔点为-70.0℃。请回答:
(1)写出装置A中发生反应的离子方程式___________________________________________。
(2)装置C中的试剂是______________;装置F的作用是_____________________________;
装置E中的h瓶需要冷却的理由是_____________________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①反应的离子方程式:______________。
②滴定前是否要滴加指示剂?_____(填“是”或“否”),请说明理由___________________。
③滴定前检验Fe3+是否被完全还原的实验操作是__________________________________。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O浓硫酸防止空气中的水进入H中产物SiCl4沸点低,需要冷凝收集5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O否KMnO4溶液的紫红色可指示反应终点取少量还原后的溶液于试管中,滴加KSCN溶液,若不出现血红色,表明Fe3+已完全还原
Mn2++Cl2↑+2H2O浓硫酸防止空气中的水进入H中产物SiCl4沸点低,需要冷凝收集5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O否KMnO4溶液的紫红色可指示反应终点取少量还原后的溶液于试管中,滴加KSCN溶液,若不出现血红色,表明Fe3+已完全还原
【解析】
制四氯化硅是由粗硅与Cl2反应得到的,所以必须先制得Cl2,因SiCl4极易水解,所以Cl2须干燥,再根据表格数据分析提纯SiCl4的方法。
(1)装置A是制取氯气的,所以发生反应的离子方程式是MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。(2)四氯化硅遇水极易水解,所以和二氧化硅反应的氯气必须是干燥的,则在氯气通入装置D之前需要干燥处理,即装置C中的试剂是浓硫酸,同样原因装置F中的碱石灰防止空气中的水进入H中,同时起到吸收过量氯气,防止氯气污染环境的作用;SiCl4的熔点较低,所以作用是使SiCl4冷凝。(3)①酸性高锰酸钾溶液就有强氧化性,能把亚铁离子氧化生成铁离子,反应的离子方程式是5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;②由于酸性高锰酸钾溶液,在溶液中显紫红色,所以不需要另加指示剂。因此终点时的现象是当滴入最后一滴KMnO4溶液时,溶液颜色由无色变为紫色,且30秒不褪色;③若Fe3+被完全还原,溶液中就不存在Fe3+,滴加KSCN溶液,溶液不会变红色。
Mn2++Cl2↑+2H2O。(2)四氯化硅遇水极易水解,所以和二氧化硅反应的氯气必须是干燥的,则在氯气通入装置D之前需要干燥处理,即装置C中的试剂是浓硫酸,同样原因装置F中的碱石灰防止空气中的水进入H中,同时起到吸收过量氯气,防止氯气污染环境的作用;SiCl4的熔点较低,所以作用是使SiCl4冷凝。(3)①酸性高锰酸钾溶液就有强氧化性,能把亚铁离子氧化生成铁离子,反应的离子方程式是5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;②由于酸性高锰酸钾溶液,在溶液中显紫红色,所以不需要另加指示剂。因此终点时的现象是当滴入最后一滴KMnO4溶液时,溶液颜色由无色变为紫色,且30秒不褪色;③若Fe3+被完全还原,溶液中就不存在Fe3+,滴加KSCN溶液,溶液不会变红色。


科目:高中化学 来源: 题型:
【题目】下面有关过渡元素的说法正确的是
A.新型高效催化剂多与过渡元素有关B.高效低毒农药多与过渡元素有关
C.过渡元素中只有铁、锰等少数元素存在变价D.大多数过渡元素的单质不能与酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个电化学过程的示意图,回答下列问题:
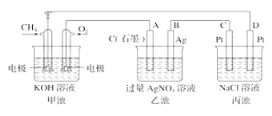
(1)甲池将__________能转化为__________能,乙装置中电极A是__________极。
(2)甲装置中通入CH4一极的电极反应式为 __________
(3)一段时间,当丙池中产生112 mL(标准状况)气体时,均匀搅拌丙池,所得溶液在25℃时的pH=__________(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入__________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.增加反应物浓度可增大单位体积的活化分子数,活化分子百分数保持不变
B.升高温度可以增大活化分子百分数,从而加快化学反应速率
C.压缩容器容积增大压强,活化分子百分数增大,从而加快任一反应的化学反应速率
D.催化剂可以降低反应所需的活化能,活化分子百分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
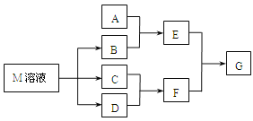
(1)写出用惰性电极电解M溶液的离子方程式__________。写出F的电子式___________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是______________。
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,如图所示,“则A与B溶液”反应后溶液中的溶质化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物。则下列说法错误的是
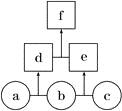
A. 常温下,单质a呈气态 B. 单质c具有强氧化性
C. 稳定性:d>e D. f受热易分解为d和e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属腐蚀与防护的说法不正确的是( )
A.酸雨湖易发生析氢腐蚀、沙锅存留盐液时易发生吸氧腐蚀
B.当镀锡铁制品的镀层破损时,铁不易被腐蚀
C.铁与电源负极相连可实现电化学保护
D.将钢管与锌管一起堆放时可保护钢管少受腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求用正确的化学用语回答下列问题:
(1)若116号元素用R表示其元素符号,则其最高价氧化物的化学式__________;
(2)写出含有8个质子、10个中子的原子化学符号_____________;
(3)用电子式表示Na2S的形成过程:_______________________________________;
(4)相同物质的量的D2O和H2O中,中子数之比是 ______________ ;
(5)如果氯化钠是由23Na及37Cl两种原子组成,则0.5mol氯化钠中含有的中子数为_______个。
(6)因为红磷比白磷稳定,所以燃烧相同质量的红磷和白磷,___________(填“白磷”或“红磷”)放出的热量多。
(7)除杂:除去乙烷中乙烯所涉及的化学方程式为________________________________ ;
(8)写出制备硝基苯的化学方程式____________________________________________ ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com