
| A. | Mg2+、Cl-、Na+、NO3- | B. | K+、Na+、NO3-、HCO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Na+、Cl-、AlO2-、SO42- |
分析 某溶液能溶解Al(OH)3,因具有两性,既能与酸反应,也能与碱反应,则溶液可能呈碱性,也可能呈酸性,分别判断在碱性或酸性条件下离子之间能否发生反应.
解答 解:某溶液能溶解Al(OH)3,为强酸或强碱溶液,
A.碱性条件下Mg2+不能大量共存,生成沉淀,故A错误;
B.在碱性或酸性条件下HCO3-离子都不能大量存在,故B错误;
C.在碱性或酸性条件下该题中四种离子都不发生任何反应,能大量共存,故C正确;
D.酸性条件下AlO2-离子不能大量存在,故D错误.
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
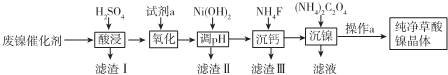
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,不考虑立体异构)是临床上使用广泛的药物.下图所示的为其多条合成路线中的一条(反应试剂和反应条件均未标出)
,不考虑立体异构)是临床上使用广泛的药物.下图所示的为其多条合成路线中的一条(反应试剂和反应条件均未标出)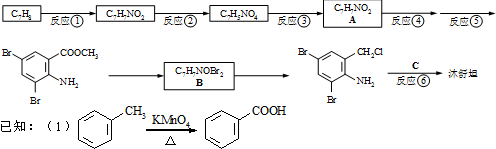
 +2
+2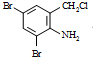 +K2CO3→2
+K2CO3→2 +2KCl+CO2↑+H2O
+2KCl+CO2↑+H2O B
B
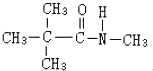 、
、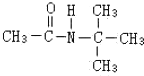
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表.
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表.| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/molkJ/mol,I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 Ni |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=10-13mol/L的溶液中:NO3-、S2O32-、K+、Na+ | |
| B. | 酸性高锰酸钾溶液中:Na+、C2O42-、CH3COO -、NH4+ | |
| C. | 澄清石灰水中:HCO3-、Ba2+、Cl-、NO3- | |
| D. | 空气中:SO2、NO、N2、NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com