
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 简单实验方案 | 预测的实验现象 | 结论 |
向褪色后的溶液中再加入过量NaOH溶液 向褪色后的溶液中再加入过量NaOH溶液 |
溶液又变红色 溶液又变红色 |
假设 ① ① 成立 |
溶液颜色无变化 溶液颜色无变化 |
假设 ② ② 成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A是重要的合成原料,在医药、染料、香料等行业有着广泛的应用。由A可以制得麻黄碱和其他很多物质。现有如下转化关系图(略去了由A→G,G→麻黄碱的部分反应物和条件):

请回答下列问题:
(1)关于麻黄碱下列说法正确的是 (填字母)。
a.麻黄碱的分子式为C10H15NO
b.1mol麻黄碱可以对应消耗1molHCl或NaOH
c.麻黄碱可以发生消去和酯化反应
d.麻黄碱属于芳香烃
(2)已知有机物A的相对分子质量为106,A中含碳、氢、氧的质量之比为42:3:8,
则A的含氧官能团名称是 ;检验该官能团的实验是 。
(3)反应①~⑤中属于取代反应的是 (填序号)。
(4)写出D—B的化学方程式 。
(5)F可作多种香精的定香剂,请写出B和C反应生成F的化学方程式 。
(6)写出符合下列条件的同分异构体的结构简式 。
①与中间产物G互为同分异构体
②既能发生消去反应,又能发生酯化反应
③苯环上的一氯取代物只有两种,分子结构中没有甲基
(7)已知:
| 溶解性 | 沸点 | |
| A | 微溶于水 | 179.0℃ |
| E | 不溶于水 | 110.8℃ |
A可以由E制取,制取工艺中得到的是A、E混合物,分离该混合物的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
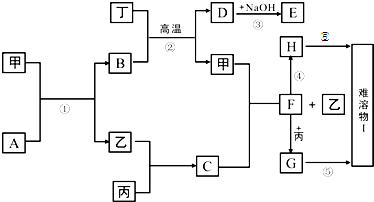
下图中的每一方格表示有关的一种反应物或生成物,其中甲、乙、丙、丁为常见单质,其余均为化合物,A是一种常见的液态化合物,B是具有磁性的氧化物,D和丁既能和酸反应又能和碱反应,乙在丙中燃烧产生苍白色火焰,它们的转化关系如下:(有些反应的条件和部分产物未注明)
 |
(1)上述反应中属于氧化还原反应的是 (填写序号)
(2)写出下列物质化学式:B ,D ,F ;
(3)写出反应的化学方程式:A+甲
(4)H在空气中很容易被氧化成I,该过程的实验现象是 ; 将足量的CO2通入E溶液中,离子方程式是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
I、(10分)过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~F涉及H2O2的反应,回答相关问题:
A.2 H2O2=2 H2O+O2↑ B.Na2O2 +2HCl= 2NaCl+H2O2
C.Ag2O+ H2O2=2Ag+O2↑+ H2O
D.3 H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8 H2O
E.H2O2+MnSO4 = MnO2 + H2SO4 F.H2O2 +2Fe2++2H+== 2Fe3++2H2O
(1)上述反应不属于氧化还原反应的是(填代号)_____________。
(2)H2O2仅体现还原性的反应是(填代号) 。
(3)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(4)通过以上反应分析,H2O2常称为绿色氧化剂,原因是___________________
(5)上述反应说明H2O2、Ag2O、MnO2氧化性由强到弱的顺序是:
II、(6分)某实验小组为探究ClO-、I2、SO![]() 在酸性条件下的氧化性强弱,设计实验如下:实验①:在淀粉碘化钾溶液中加入少量次氯酸钠(NaClO)溶液,并加入少量的稀硫酸,只发现溶液立即变蓝;(已知I2遇淀粉变蓝)
在酸性条件下的氧化性强弱,设计实验如下:实验①:在淀粉碘化钾溶液中加入少量次氯酸钠(NaClO)溶液,并加入少量的稀硫酸,只发现溶液立即变蓝;(已知I2遇淀粉变蓝)
实验②:向实验①的溶液中加入4 mL 0.5 mol/L的亚硫酸钠(Na2SO3)溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式
(2)实验②的化学反应中转移电子的物质的量是____________。
(3)以上实验说明,在酸性条件下ClO-、I2、SO![]() 的氧化性由弱到强的顺序是________。
的氧化性由弱到强的顺序是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com