
| A. | 12 | B. | 16 | C. | 24 | D. | 32 |
分析 一氯代烃A(C5H11Cl)经水解后再氧化得到有机物B,A的一种同系物(C4H9Cl)经水解得到有机物C,B和C可发生酯化反应生成酯D,则B为羧酸,分子式为C4H9COOH、C为醇,分子式为C4H9OH,且含有相同的碳原子数目,分析-C4H9的异构种类,乘积即为D可能的结构种数.
解答 解:一氯代烃A(C5H11Cl)经水解后再氧化得到有机物B,A的一种同系物(C4H9Cl)经水解得到有机物C,B和C可发生酯化反应生成酯D,则B为羧酸,分子式为C4H9COOH、C为醇,分子式为C4H9OH,且含有相同的碳原子数目.
-C4H9的异构情况为正丁基:-CH2CH2CH2CH3、
异丁基:-CH2CH(CH3)2、
仲丁基:-CH(CH3)-CH2-CH3、
叔丁基:-C(CH3)3共4种,
说明BC有4种可能结构;
D可能的结构有4×4=16种,
故选B.
点评 本题考查有机物推断,涉及同分异构体、卤代烃及醇、羧酸、酯的性质,掌握官能团的性质与转化是解题基础,正确判断同分异构体的种类是关键,难度中等,注意掌握同分异构体的解题方法.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题
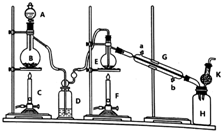 制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:
制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:| 物质 | 摩尔质量/(g•mol-1) | 熔点/℃ | 沸点/℃ |
| Sn | 119 | 232 | 2260 |
| SnCl2 | 190 | 246.8 | 623 |
| SnCl4 | 261 | -30.2 | 114.1 |
| MnO2 | 87 | 535(分解) | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
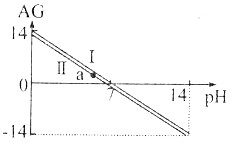
| A. | AG与pH的关系一定是AG=14-2pH | |
| B. | 直线Ⅰ和Ⅱ是因溶液的温度不同引起的,且T(Ⅰ)>T(Ⅱ) | |
| C. | AG=0时,溶液一定呈中性 | |
| D. | a点的溶液中可以有大量Na+、Cl-、Fe3+存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
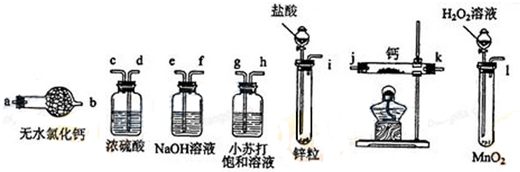
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中Cu2+与Fe2+的物质的量比为1:2 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 氧化性:Zn2+>Cu2+>Fe3+>Ag+ | |
| D. | 1 mol Fe可还原2 mol Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数的大小与温度、浓度、压强、催化剂等有关 | |
| B. | Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-(aq)?AgI(s)+Cl-(aq)能够发生 | |
| C. | 当温度升高时,弱酸的电离平衡常数Ka变小 | |
| D. | 化学平衡常数不变时,说明化学反应已达化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,该气体能使澄清石灰水变浑浊,则原溶液中一定有CO32- | |
| B. | 鉴别碳酸钠溶液和碳酸氢钠溶液,可以用稀CaCl2 溶液 | |
| C. | 做焰色反应时,每次实验要将铂丝用水洗干净,再蘸取其他物质在灯焰上灼烧 | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
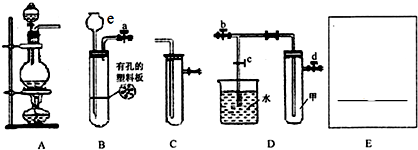
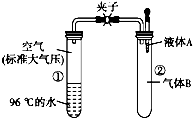 如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )| A. | 氢氧化钠溶液、二氧化碳 | B. | 饱和食盐水、氯化氢 | ||
| C. | 氢氧化钠溶液、一氧化碳 | D. | 石灰水、二氧化硫 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com