
右图中的曲线是在其他条件一定时反应:2NO(g)+O2(g) 2NO2(g)(正反应放热)中NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且v正>v逆的点是(
)
2NO2(g)(正反应放热)中NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且v正>v逆的点是(
)
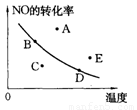
A.A或E B.C C.B D.D
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| 试验序号 | 实验步骤 | 实验现象 | 结论 |
| ① | 取少量该焰火原料, 加入冷水 |
无明显现象 | 合金中不含Li、Na等活泼金属 合金中不含Li、Na等活泼金属 |
| ② | 取少量该焰火原料, 加入足量稀盐酸 |
完全溶解,有大量气体 产生、溶液呈无色 |
含有能与盐酸反应的较活泼的金属 含有能与盐酸反应的较活泼的金属 |



查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省金丽衢十二校高三第二次联考理综化学试卷(解析版) 题型:填空题
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾履形成的原因。
(1)汽车尾气净化的主要原理为;2NO(g)+2CO(g)  N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是____。
A.在单位时问内生成1mol CO2的同时消耗了lmol CO
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.混合气体的压强不再变化
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:
?? 
③若要同时提高该反应的速率和NO的转化率,采取的措施有_____、____。(写出2个)
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应原理为C(s)+H2O(g) CO(g)+H2(g) △H=+131.3kJ/mol。
CO(g)+H2(g) △H=+131.3kJ/mol。
①该反应在___下能自发进行(填“高温”或“低温”)。
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为____。(已知:H2S: Ka1=9.1×10-8;Ka2=1.1×10-12。H2CO3:Ka1=4.30×10-7;Ka2=5.61×10-11)
(3)已知反应:CO(g)+H2O(g) CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1条件下平衡常数K=______(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是______。
③该反应的△H ______0(填“<”或“>”);若在9000C时,另做一组实验,在此容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时υ正______υ逆(填“<”,“>”,“=”)。
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都外国语学校高一下学期期中考试化学试卷(解析版) 题型:填空题
(I)(10分)某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
|
实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
|
① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和__探究温度对该反应速率的影响; (Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。 |
|
② |
|
|
|
|
|
③ |
|
粗颗粒 |
|
|
|
④ |
|
|
|
(II)(5分) 800℃时在2 L密闭容器内加入NO和O2,发生反应:2NO(g)+O2(g) 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)NO的平衡浓度c(NO)= ;
(2)用O2表示从0~2s内该反应的平均反应速率为 ;
(3)右图中表示NO2变化的曲线是 ;

(4)在其他条件不变,5min时分别改变下列条件,将改变条件后反应速率的变化情况(“增大”、“减小”或“不变”)填入空格内:①升温 V ②体积不变充入He气体 V
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省汕头市金山中学高二10月月考化学试卷(带解析) 题型:单选题
右图中的曲线是在其他条件一定时反应:2NO(g)+O2(g) 2NO2(g)(正反应放热)中NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且v正>v逆的点是( )
2NO2(g)(正反应放热)中NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且v正>v逆的点是( )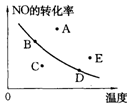
A.A或E B.C C.B D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com