
| 选项 | A | B | C | D |
| 操作或装置 |  | 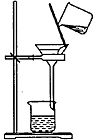 | 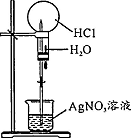 | 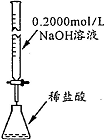 |
| 目的 | 配制一定物质的量浓度溶液 | 分离Na2CO2溶液和CH3COOC2H5的混合物 | 做“白色”喷泉实验 | 用NaOH溶液滴定稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.转移液体需要引流;
B.Na2CO2溶液和CH3COOC2H5的混合物分层;
C.HCl与硝酸银溶液反应生成白色沉淀,烧瓶内气体减少,外压大于内压;
D.NaOH不能用酸式滴定管盛放.
解答 解:A.转移液体需要引流,图中缺少玻璃棒,故A错误;
B.Na2CO2溶液和CH3COOC2H5的混合物分层,应选分液装置,而图中为过滤装置,故B错误;
C.HCl与硝酸银溶液反应生成白色沉淀,烧瓶内气体减少,外压大于内压,则图中装置可做白色”喷泉实验,故C正确;
D.NaOH不能用酸式滴定管盛放,应选碱式滴定管,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握溶液配制、中和滴定、混合物分离提纯及喷泉实验原理为解答的关键,侧重分析与实验能力的综合考查,注意实验装置的作用及实验仪器的使用,题目难度不大.


科目:高中化学 来源: 题型:解答题
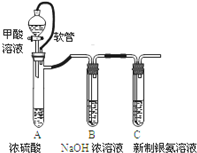 | 已知:①银氨溶液的化学式为: Ag(NH3)2OH ②反应结束后试管C底部有黑色 沉淀生成, ③分离出上层清液和底部黑色 固体备用. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象 | 解释或结论 |
| A | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中龠Na+,不含K+ |
| B | 向某溶液中滴加KSCN溶液,无明显现象,再滴加 少量氯水,溶液变成红色 | 溶液中含有Fe2+,没有Fe3+ |
| C | 向苯中滴入少量浓溴水,振荡,精置分层,上层呈橙红色,下层几乎无色 | 苯和溴水发生取代反应,使溴水褪色 |
| D | 在少量无水乙醇中加入金属Na+,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 反应时间min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 增大压强对正逆反应速率没有影响,平衡不移动 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O(g),达到平衡时n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | |
| D. | 由表格中数据得出,t1时刻该反应还未达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
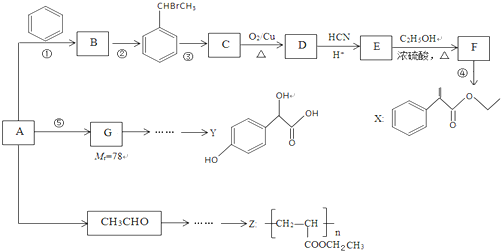
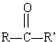 $→_{H+}^{HCN}$
$→_{H+}^{HCN}$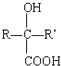 R或R′可以是烃基或氢原子
R或R′可以是烃基或氢原子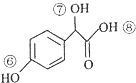 的说法正确的是AD.
的说法正确的是AD. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


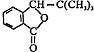
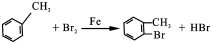 ,F的结构简式
,F的结构简式 .
.
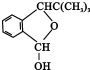 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯食品袋耐高温加热 | |
| B. | 石英玻璃仪器耐酸碱腐蚀 | |
| C. | 羊毛织物可用强碱性洗涤剂清洗 | |
| D. | 把铅加入锡中制造焊锡的目的是降低熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
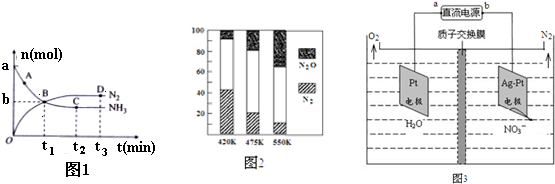
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com