
| A、玻璃是硅酸盐,有固定的熔点 | B、玻璃是几种成分融化在一起的晶体 | C、普通玻璃的成分主要是硅酸三钙、硅酸二钙和铝酸三钙 | D、制造普通玻璃的主要原料是纯碱、石灰石、石英 |
| ||
| ||


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
A、氯碱厂电解饱和食盐水溶液制取NaOH,为了有效地除去粗盐水中Ca2+、Mg2+、
| ||
| B、在接触法制硫酸的工业生产中,SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率 | ||
| C、以石灰石、纯碱、石英为原料,在玻璃窑中加强热制取普通玻璃 | ||
| D、合成氨生产过程中将NH3液化分离,可增大正反应速率,提高N2、H2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
新华网2月22日电 截至22日15时,山西屯兰煤矿事故已造成73人遇难。据事故抢险指挥部介绍,现已初步查明,事故原因为井下局部瓦斯爆炸。该矿发生事故时井下共有矿工436人,有375人陆续升井。升井后经抢救无效死亡的和井下已发现遇难遗体的矿工共计73人。现有113人住院观察,其中21人伤势较重。目前,山西仍在全力搜救被困者,第一轮搜救已于14时结束,目前第二轮搜救排查已经展开,同时山西省还采取措施防止次生灾害发生。煤矿发生爆炸事故的元凶是煤矿坑道气中含有的甲烷。
![]() ⑴下列关于甲烷的叙述中错误的是( )
⑴下列关于甲烷的叙述中错误的是( )
![]() A.甲烷分子是一种呈正四面体型的、含极性键的非极性分子
A.甲烷分子是一种呈正四面体型的、含极性键的非极性分子
![]() B.甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子
B.甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子
![]() C.甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业
C.甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业
![]() D.“抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸
D.“抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸
![]() ⑵已知某正四面体形分子E和直线形分子G在光照条件下反应,生成一种直线形分子M和变形的四面体L(组成E.G.L.M分子的元素原子序数均小于18),且G分子中的原子处于E分子最大原子的下一周期。反应过程图示如下:
⑵已知某正四面体形分子E和直线形分子G在光照条件下反应,生成一种直线形分子M和变形的四面体L(组成E.G.L.M分子的元素原子序数均小于18),且G分子中的原子处于E分子最大原子的下一周期。反应过程图示如下:
![]()
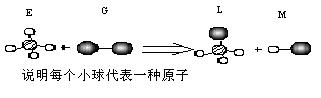
![]() 利用E与G发生取代反应制取副产品M溶液的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:
利用E与G发生取代反应制取副产品M溶液的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:
![]()
![]()

根据要求填空:
![]() ①B装置有三种功能:①控制气流速度;②均匀混合气体;③
①B装置有三种功能:①控制气流速度;②均匀混合气体;③
![]() ②设V(G)/V(E)=x,若理论上欲获得最多的M,则x值应
②设V(G)/V(E)=x,若理论上欲获得最多的M,则x值应
![]() ③D装置的石棉中均匀混有KI粉末,其作用是 。
③D装置的石棉中均匀混有KI粉末,其作用是 。
![]() ④E装置的作用是 (填编号)
④E装置的作用是 (填编号)
![]() A.收集气体 B.吸收G物质 C.防止倒吸 D.吸收M物质
A.收集气体 B.吸收G物质 C.防止倒吸 D.吸收M物质
![]() ⑤在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。
⑤在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。
![]() ⑥E装置出生成盐酸外,还含有有机物,从E中分离出M的最佳方法为 。
⑥E装置出生成盐酸外,还含有有机物,从E中分离出M的最佳方法为 。
![]() 该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为
该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题


查看答案和解析>>
科目:高中化学 来源:模拟题 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:
关于工业生产的下列叙述,正确的是( )
A.氯碱厂电解饱和食盐水溶液制取NaOH,为了有效地除去粗盐水中Ca2+、Mg2+、SO42-,加入试剂的合理顺序为:先加入NaOH,后加入Na2CO3,再加入BaCl2
B.在接触法制硫酸的工业生产中,SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率
C.以石灰石、纯碱、石英为原料,在玻璃窑中加强热制取普通玻璃
D.合成氨生产过程中将NH3液化分离,可增大正反应速率,提高N2、H2的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com