
����Ŀ��ij��ȤС�����������ʵ��װ�ã�ʵ��ʱ���ȶϿ�K2 �� �պ�K1 �� �����������ݲ�����һ��ʱ��Ͽ�K1 �� �պ�K2 �� ���ֵ�����ָ��ƫת�������й�������ȷ���ǣ� �� 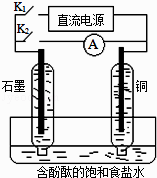
A.�Ͽ�K2 �� �պ�K1ʱ���ܷ�Ӧ�����ӷ���ʽΪ��2H++2Cl�� ![]() Cl2��+H2��
Cl2��+H2��
B.�Ͽ�K2 �� �պ�K1ʱ��ʯī�缫������Һ���
C.�Ͽ�K1 �� �պ�K2ʱ��ͭ�缫�ϵĵ缫��ӦΪ��Cl2+2e��=2Cl��
D.�Ͽ�K1 �� �պ�K2ʱ��ʯī�缫������
���𰸡�D
���������⣺A���Ͽ�K2 �� �պ�K1ʱ���ǵ���װ�ã���ⱥ��ʳ��ˮ���ܷ�Ӧ�����ӷ���ʽΪ2H2O+2Cl�� ![]() Cl2��+H2��+2OH������A���� B���Ͽ�K2 �� �պ�K1ʱ���ǵ���װ�ã������������ݲ�����˵����������������ֱ�����������������˻��ý���Cu������������Cu��������ʯī�������������ϣ�ʯī�缫�ϣ�������ʧ���ӷ���������Ӧ�������ϣ�Cu�缫�ϣ������ӵõ����ӷ�����ԭ��Ӧ������ˮ�ĵ���ƽ�⣬����������Ũ�������̪��죻��B����
Cl2��+H2��+2OH������A���� B���Ͽ�K2 �� �պ�K1ʱ���ǵ���װ�ã������������ݲ�����˵����������������ֱ�����������������˻��ý���Cu������������Cu��������ʯī�������������ϣ�ʯī�缫�ϣ�������ʧ���ӷ���������Ӧ�������ϣ�Cu�缫�ϣ������ӵõ����ӷ�����ԭ��Ӧ������ˮ�ĵ���ƽ�⣬����������Ũ�������̪��죻��B����
C���Ͽ�K1 �� �պ�K2ʱ�����ֵ�����ָ��ƫת��֤����ԭ��ط�Ӧ���γ�����ȼ�ϵ�أ�������������֪��Cu�缫�ϲ�����������ʯī�缫�ϲ��������������ͭ����������������Ӧ������ʧ�������������ӵķ�Ӧ����C����
D���Ͽ�K1 �� �պ�K2ʱ�����ֵ�����ָ��ƫת��֤����ԭ��ط�Ӧ���γ�����ȼ�ϵ�أ�ʯī�缫�ϲ���������������ԭ�����������D��ȷ��
��ѡD��
A���Ͽ�K2 �� �պ�K1ʱ���ǵ���װ�ã������������ݲ�����˵����������������ֱ�����������������˻��ý���Cu������������
B���Ͽ�K2 �� �պ�K1ʱ���ǵ���װ�ã������������ݲ�����ʯī����������Һ��������ʧ���ӷ���������Ӧ��ͭ�������������ӵõ����ӷ�����ԭ��Ӧ������ˮ�ĵ���ƽ�⣬����������Ũ������
C���Ͽ�K1 �� �պ�K2ʱ�����ֵ�����ָ��ƫת��֤����ԭ��ط�Ӧ���γ�����ȼ�ϵ�أ�ͭ����������ʧ���ӷ���������Ӧ��
D���Ͽ�K1 �� �պ�K2ʱ�����ֵ�����ָ��ƫת��֤����ԭ��ط�Ӧ��ʯī��ԭ���������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С��Ϊ��̽�������������Ӧ�����������˼���ʵ�顣
����д���пհף�
[ʵ��һ]����ͼ��ʾװ�ã��ռ�һ�Թܼ���������Ļ�����壬���պ�۲쵽����Ͳ���γ�һ��ˮ������Ϊ���Ȼ������ɡ�
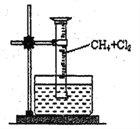
(1)�÷�Ӧ�ķ�Ӧ����Ϊ_____________________��
(2)�÷�Ӧ�Ļ�ѧ����ʽΪ(ֻд��һ��)______________��
(3)ˮ����ʢ�ŵ�Һ��ӦΪ_______��(����)
A.ˮ B.����ʯ��ˮ C.����ʳ��ˮ D.����NaHCO3��Һ
(4)��ʵ���ʵ������Ϊ��____________��_____________���Թܱ��ϳ�����״Һ��
(5)����״Һ���к��е��л����ﹲ��_______�֡�
[ʵ���]�ռ�һ�Թܼ���������Ļ�����壬���շ�Ӧ�μ�AgNO3��Һ�������а�ɫ�������ɣ���Ϊ���Ȼ������ɡ�
(6)����Ϊ��ʵ����Ƶó��Ľ����Ƿ���ȷ��______��������ȷ�������ǣ�_________________��
[ʵ����]����һ:�ռ����Թ�����������10mL����ˮ�����������DISϵͳ��pH����������Һ��pH(��ͬ)�����pH=3.26
�����:�ռ�һ�Թܼ����������Ļ������(��ռ50%)����40W���չ���¹���6min����l0mL����ˮ����������pH=1.00��
(7)�жϸ÷�Ӧ�����Ȼ������ɵ�������__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���ѧ��Ӧʱ����Ҫ�������ʱ仯�������仯��ҲҪ��ע��Ӧ�Ŀ������ȡ��ش���������:
I.���з�Ӧ:��CaCO3=CaO+CO2������Fe +H2SO4=FeSO4+ H2����
��1������Ӧ���������ȷ�Ӧ����____(�����)��
��2��Fe-Cu ԭ��ص�װ����ͼ��ʾ��
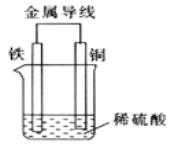
����Һ��H+��______(������������ͭ�� )�缫�����ƶ���
��������������_______�������ĵ缫��ӦʽΪ_________��
II.ij���淴Ӧ:2A(g)![]() B(g)+D(g)��3 �ֲ�ͬ�����½��У�B��D����ʼŨ�Ⱦ�Ϊ0����Ӧ��A ��Ũ���淴Ӧʱ��ı仯������±�:
B(g)+D(g)��3 �ֲ�ͬ�����½��У�B��D����ʼŨ�Ⱦ�Ϊ0����Ӧ��A ��Ũ���淴Ӧʱ��ı仯������±�:
 ��3��ʵ��1�У���10~20 min�ڣ�������A��ʾ��ƽ����Ӧ����Ϊ_______mol/(L��min) ��50minʱ��v(��)______(����<����>������=��)v(��)��
��3��ʵ��1�У���10~20 min�ڣ�������A��ʾ��ƽ����Ӧ����Ϊ_______mol/(L��min) ��50minʱ��v(��)______(����<����>������=��)v(��)��
��4��0~20min����ʵ��2 ��ʵ��1�ķ�Ӧ����______ (����������������)����ԭ�������_______��
��5��ʵ��3 ��ʵ��1�ķ�Ӧ���ʿ�����ԭ����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӧ����������������أ�����˵��������ǣ� ��
A.�轺�ɷ�ֹʳ���ܳ��������������ˮ��
B.����������ҽ����Һ����Ϊ������ǿ�����
C.Na2CO3������ʳ�ü��ΪNa2CO3��ˮ��Һ�Լ���
D.�����ظ�������ڼ��Ƽ���������ǿ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӧ�úʹ������Ļ��������������������Ҫ���壮
��1������[CO��NH2��2]��һ�ָ�Ч���ʣ�Ҳ��һ�ֻ���ԭ�ϣ�
��������Ϊԭ����һ�������·�����Ӧ��CO��NH2��2 ��s��+H2O��l��2NH3��g��+CO2��g����H=+133.6kJ/mol���÷�Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽK= �� ���ڸ÷�Ӧ������˵����ȷ����������ţ���
a���ӷ�Ӧ��ʼ��ƽ��ʱ�����л�������ƽ����Է����������ֲ���
b����ƽ����ϵ������ˮ��������ʹ�÷�Ӧ��ƽ�ⳣ������
c�������¶�ʹ���ص�ת��������
��������һ�������¿ɽ����������ﻹԭΪ������
��֪�� 
��Ϣ�����Ϣ�����ػ�ԭNO��g�����Ȼ�ѧ����ʽ�� ��
���ܱ��������Ե����ʵ�����NH3��CO2Ϊԭ�ϣ���120�桢���������·�Ӧ�������أ�CO2��g��+2NH3��g���TCO ��NH2��2 ��s��+H2O��g�������������NH3�����ʵ����ٷֺ���[�գ�NH3��]��ʱ��仯��ϵ��ͼ2��ʾ
��a�������Ӧ����v����CO2��b����淴Ӧ����v���棩��CO2�������������=����������������ƽ��ת������ ��
��2��NO2����Ⱦ����������Na2CO3��Һ����NO2������CO2 �� ��֪9.2g NO2��Na2CO3��Һ��ȫ��Ӧʱת�Ƶ���0.1mol���˷�Ӧ�����ӷ���ʽ����ǡ�÷�Ӧ��ʹ��Һ�е�CO2��ȫ�ݳ���������Һ�������ԣ�����Һ�д��ڵ���������Ũ�ȴ�С��ϵ��c��Na+���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������˵����ȷ���ǣ�������
A.��״���£�22.4 L������O2��N2��������ĿΪNA
B.0.1 mol�ǻ�������������ĿΪNA
C.28 g��ϩ����ϩ�������������ԭ����Ϊ6NA
D.5.6 g����������ȫ��Ӧʱת�Ƶĵ�����ĿΪ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȫ���������ʵ���Ũ�ȵ�NaCl��MgCl2��AlCl3������Һ��Cl�������ĵ����ʵ���Ũ�ȵ�AgNO3��Һ�������Ϊ3��2��1��������������Һ�������Ϊ
A. 6��3��2 B. 1��1��1 C. 9��3��1 D. 3��2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ��Cl��Ũ��������
A.200mL2mol/L�Ȼ�����ҺB.100mL1mol/L�Ȼ�����Һ
C.500mL1mol/L�Ȼ�þ��ҺD.100gҺ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڵ��ʳ��ˮ֮ǰ����Ҫ�ᴿʳ��ˮ��Ϊ�˳�ȥ�����е�Ca2����Mg2����SO42������ɳ���ɽ���������ˮ��Ȼ��������������������ȷ�IJ���˳���� ( )
�ٹ��ˡ� �ڼӹ�����NaOH��Һ ���ۼ����������ᡡ�ܼӹ�����̼������Һ �ݼӹ������Ȼ�����Һ
A.�٢ܢڢݢ�B.�ܢ٢ڢݢ�C.�ڢݢܢ٢�D.�ݢڢܢۢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com