
| A. | (a+0.5b-1.5c) kJ•mol-1 | B. | (a-0.5b+1.5c) kJ•mol-1 | ||
| C. | (2a+b-3c) kJ•mol-1 | D. | (2a+b+3c) kJ•mol-1 |
分析 若①N2(g)+O2(g)=2NO(g)△H=+akJ•mol-1,
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-bkJ•mol-1,
③2H2(g)+O2(g)=2H2O(g)△H=-ckJ•mol-1
由盖斯定律可知,①-$\frac{1}{2}$×②+$\frac{3}{2}$×③得到N2(g)+3H2(g)?2NH3(g),以此计算反应热.
解答 解:若①N2(g)+O2(g)=2NO(g)△H=+akJ•mol-1,
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-bkJ•mol-1,
③2H2(g)+O2(g)=2H2O(g)△H=-ckJ•mol-1
由盖斯定律可知,①-$\frac{1}{2}$×②+$\frac{3}{2}$×③得到N2(g)+3H2(g)?2NH3(g),则△H=(+akJ•mol-1)-(-bkJ•mol-1)×$\frac{1}{2}$+(-ckJ•mol-1)×$\frac{3}{2}$=(a+0.5b-1.5c) kJ•mol-1,
故选A.
点评 本题考查反应热与焓变,为高频考点,把握盖斯定律计算反应热为解答的关键,侧重分析与计算能力的考查,注意已知反应与目标反应的关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 加三聚氰胺提高牛奶的含氮量 | |
| B. | 用苏丹红(色素)作食品着色剂 | |
| C. | 加小苏打(NaHCO3)作馒头的膨松剂 | |
| D. | 用含有甲醇(CH3OH)的工业酒精兑制饮用白酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非自发的氧化还原反应不可以设计成原电池 | |
| B. | 将反应 3Cu+8HNO3═3Cu(NO3)2+2NO+4H2O 设计成原电池,其正极反应为:2NO3-+6e-+8H+═2NO+4H2O | |
| C. | 铅蓄电池工作时,正极、负极质量均增加 | |
| D. | 氢氧燃料电池耗H20.1mol时,电路中流经的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
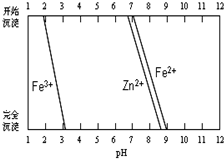 铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人类目前所利用的能量大部分是由化学反应产生的 | |
| B. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| C. | 我国目前最主要的能源是石油 | |
| D. | 能量变化是化学反应的基本特征之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时,仰视刻度线 | B. | 称量用了生锈的砝码 | ||
| C. | 未洗涤溶解NaOH的烧杯 | D. | 容量瓶未经过干燥即用来配制溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离碘单质和四氯化碳的混合物需要烧杯、玻璃棒和漏斗 | |
| B. | 用湿润的pH试纸测定溶液的pH一定会产生误差 | |
| C. | 实验室可以向浓硫酸中滴加浓盐酸制取少量氯化氢 | |
| D. | 用浓氨水可以除去试管内壁银镜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com