
һ���¶��£���4���ݻ���Ϊ1 L�ĺ��������зֱ���з�Ӧ(��������A������)
A(s)+B(g)  C(g)+D(g) ��H =+100 kJ��mol��1��ijʱ�̲�ò����������±���
C(g)+D(g) ��H =+100 kJ��mol��1��ijʱ�̲�ò����������±���
|
������� |
n(B)/mol |
n(C)/mol |
n(D)/mol |
��Ӧʱ��/min |
��Ӧ���� |
|
�� |
0.06 |
0.60 |
0.10 |
t1 |
v(��)=v(��) |
|
�� |
0.12 |
1.20 |
0.20 |
t2 |
|
|
�� |
0.32 |
1.0 |
0 |
0 |
|
|
�� |
0.12 |
0.30 |
|
|
v(��)=v(��) |
����˵����ȷ���� ( )
A����������ƽ����Ӧ����v(B)=0.04/t1 mol��L��1��min��1
B��t2ʱ��������v(��)��v(��)
C���������з�Ӧ��ƽ��ʱ����20 kJ
D����������c(D)= 0.4 mol��L��1
D
��������
���������A����ʱ��v������=v���棩����Ӧ��ƽ��״̬�����ڲ�֪����Ӧ�����ĸ������ƽ�⣬���ܼ�������ʵ�Ũ�ȱ仯�������ܼ��㷴Ӧ���ʣ���A����
B�������������֪�÷�Ӧ��ƽ�ⳣ��k=0.6��0.1/0.06=1��t2ʱ�������е�Ũ����Qc=1.2��0.2/0.12=2������ƽ�ⳣ��k��ƽ�����淴Ӧ�ƶ���v��������v���棩����B����
C����ƽ��ʱD�����ʵ���Ϊx���ɷ���ʽ��֪��ƽ��ʱC�����ʵ���Ϊ��1+x��mol��B�����ʵ���Ϊ��3.2-x��mol������ƽ�ⳣ����֪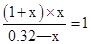 �����x=0.14�������Ȼ�ѧ����ʽ��֪��Ӧ���յ�����Ϊ100kJ��mol��1��0.14mol=14kJ����C����
�����x=0.14�������Ȼ�ѧ����ʽ��֪��Ӧ���յ�����Ϊ100kJ��mol��1��0.14mol=14kJ����C����
D���������и�ʱ��v������=v���棩����Ӧ��ƽ��״̬����D��Ũ��Ϊcmol��L��1������ƽ�ⳣ����֪0.3��c/0.12=1�����c=0.4������������c��D��=0.4 mol��L��1����D��ȷ��
��ѡ��D��
���㣺��ѧƽ��ļ��㣻��Ӧ���ʵĶ�����ʾ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 �о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����壮
�о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����壮| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| �� �� | �� | �� |
| ��Ӧ��Ͷ���� | 1molCO2��3molH2 | a molCO2��b molH2�� c molCH3OH��g����c molH2O��g�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��2013?��ɳģ�⣩2SO2��g��+O2��g��
| ||||||||||||||||||||||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | �� | �� | �� | ||
| �ܱ��������/L | 2 | 2 | 2 | 1 | |
| ��ʼ���ʵ��� | n��SO2��/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n��O2��/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2��ƽ��ת����/% | 80 | ��1 | ��2 | ��3 | |
| A�����з�Ӧ��ƽ�ⳣ��С���� |
| B�����¶��£��÷�Ӧ��ƽ�ⳣ��KΪ400 |
| C��SO2��ƽ��ת���ʣ���1����2=��3 |
| D��������SO3�����ʵ���Ũ�ȣ���=������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| �¶�/�桢00w | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| ���� | �� | �� | �� | |
| Ͷ�Ϸ�ʽ | 1molCO��2molH2 | 1molCH3OH | 2molCH3OH | |
| ƽ������ | C��CH3OH��/��mol/L�� | c1 | c2 | c3 |
| ��ϵѹǿ��Pa�� | p1 | p2 | p3 | |
| ��Ӧ�������仯 | akJ | bkJ | ckJ | |
| ԭ��ת���� | ��1 | ��2 | ��3 | |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com