
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X离子的氧化性比Y离子氧化性强 | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于氨水 | |
| D. | W单质的氧化性比Z单质强 |
分析 W化合价为-2价,没有最高正化合价+6价,故W为O元素;Z元素化合价为+5、+3、-3,Z处于ⅤA族,原子半径与氧元素相差不大,则Z与氧元素处于同一周期,则Z为N元素;X化合价为+2价,应为周期表第ⅡA族,Y的化合价为+3价,应为周期表第ⅢA族元素,二者原子半径相差较小,可知两者位于同一周期相邻主族,由于X、Y的原子半径与W、Z原子半径相差很大,则X、Y应在第三周期,所以X为Mg元素,Y为Al元素,据此结合元素周期律知识解答.
解答 解:W化合价为-2价,没有最高正化合价+6价,故W为O元素;Z元素化合价为+5、+3、-3,Z处于ⅤA族,原子半径与氧元素相差不大,则Z与氧元素处于同一周期,则Z为N元素;X化合价为+2价,应为周期表第ⅡA族,Y的化合价为+3价,应为周期表第ⅢA族元素,二者原子半径相差较小,可知两者位于同一周期相邻主族,由于X、Y的原子半径与W、Z原子半径相差很大,则X、Y应在第三周期,所以X为Mg元素,Y为Al元素,
A.同周期自左而右,金属性减弱,所以X、Y元素的金属性X>Y,X离子的氧化性比Y离子氧化性弱,故A错误;
B.在放电条件下氮气与氧气直接化合生成的是NO,故B错误;
C.Y的最高价氧化物的水化物是氢氧化铝,氢氧化铝不溶于水,也不溶于氨水,故C错误;
D.W的单质为氧气,Z的单质为氮气,氧气的氧化性大于氮气,故D正确;
故选D.
点评 本题考查元素位置结构和性质的关系及应用,题目难度中等,从原子半径的变化和元素的最高正价和最低负价入手寻求突破,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
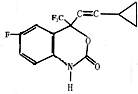 F是一种治疗艾滋病的新药(结构简式如图),已知F分子中苯环与-NH-CO-O-基团在同一平面内,关于F的以下说法正确的是( )
F是一种治疗艾滋病的新药(结构简式如图),已知F分子中苯环与-NH-CO-O-基团在同一平面内,关于F的以下说法正确的是( )| A. | F分子内最多可有13个碳原子在同一个平面内 | |
| B. | F分子内至少有8个碳原子在同一平面内 | |
| C. | F的水解产物一定都是极性分子 | |
| D. | 1molF与H2发生加成反应,消耗H2的物质的量最多是6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA | |
| C. | 标准状况下,11.2 L苯中含有分子的数目为0.5NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1 mol氧气,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$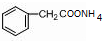 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
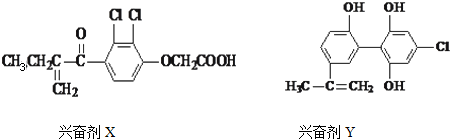
| A. | Y遇到氯化铁溶液时显紫色,Y能使溴的四氯化碳溶液褪色 | |
| B. | X的分子式为:C13H12O4Cl2 | |
| C. | 1molX与足量氢气反应,最多可消耗5molH2 | |
| D. | 1个Y分子中最多有8个碳原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液 | B. | 新制Cu(OH)2悬浊液 | C. | 石蕊试液 | D. | 溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解、过滤、蒸发 | B. | 溶解、过滤、洗涤、干燥 | ||
| C. | 溶解、过滤、结晶 | D. | 溶解、结晶、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
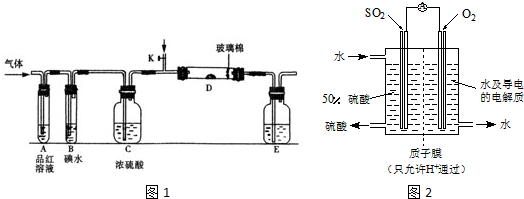
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com