
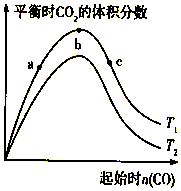
 燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注.一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol.保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):下列有关说法正确的是( )
燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注.一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol.保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):下列有关说法正确的是( )| A. | T1比T2高 | |
| B. | b点SO2转化率最高 | |
| C. | b点后曲线下降是因CO体积分数升高 | |
| D. | 减小压强可提高CO、SO2转化率 |
分析 A、CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol,正反应是放热反应,温度越高二氧化碳的含量越少;
B、增加一种反应物本身的转化率降低,但另一种物质的转化率升高;
C、一氧化碳的物质的量增加,导致一氧化碳体积分数变大,二氧化碳的体积分数减小;
D、CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)正反应是气体体积缩小的反应;
解答 解:A、CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol,正反应是放热反应,温度越高二氧化碳的含量越少,所以由图可知T1比T2低,故A错误;
B、增加一种反应物本身的转化率降低,但另一种物质的转化率升高,所以b点二氧化硫的转化率最低,而c点二氧化硫的转化率最高,故B错误;
C、一氧化碳的物质的量增加,导致一氧化碳体积分数变大,二氧化碳的体积分数减小,所以b点后曲线下降是因CO体积分数升高,故C正确;
D、CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)正反应是气体体积缩小的反应,所以增大压强,平衡正向移动,则减小压强可降低CO、SO2转化率,故D错误;
故选C.
点评 本题考查平衡移动原理,难度中等,注意判断曲线表示哪一物质的体积分数是关键,侧重考查学生对图象的分析与平衡移动的理解,难度较大.


 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液产生白色沉淀,一定含有SO42- | |
| B. | 取溶液进行焰色反应是黄色,一定含有Na+ | |
| C. | 加入碳酸钠溶液产生白色沉淀,一定含有Ca2+ | |
| D. | 加入稀盐酸产生无色气体,一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
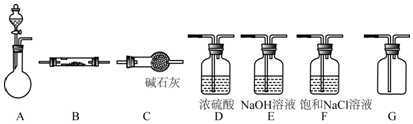
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
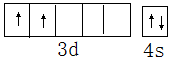

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
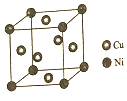 东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (X为卤素原子)
(X为卤素原子)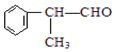 的物质,该物质是一种香料.
的物质,该物质是一种香料. $→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$
$→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$
 .
. 、2
、2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O. 、
、 、
、 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com