
室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示,下列说法正确的是
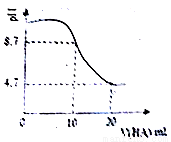
A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.b点所示溶液中c(A—)> c(HA)
C.a、b两点所示溶液中水的电离程度相同
D.pH=7时,c(Na+)= c(A—)+ c(HA)
科目:高中化学 来源:2015-2016学年广东汕头金山中学高二下第十二周练化学卷(解析版) 题型:选择题
下列说法正确的是
A.冰熔化时,分子中H-O键发生断裂
B.随着卤素原子电子层数的增加,卤化物CX4分子间作用力逐渐增大,所以它们相应的熔沸点也逐渐增高
C.由于H—O键比H—S键牢固,所以水的熔沸点比H2S高
D.在由分子所构成的物质中,分子间作用力越大,该物质越稳定
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高二下期中理科化学试卷(解析版) 题型:选择题
下列各组液体混合物,能用分液漏斗分离的是
A.溴苯和溴 B.正己烷和水 C.苯和硝基苯 D.乙醇和水
查看答案和解析>>
科目:高中化学 来源:2016届西藏日喀则一中高三下学期二模考试理综化学试卷(解析版) 题型:选择题
第三周期元素R,它的原子最外电子层达到稳定结构所所需的电子数少于次外层与最内层电子数之差,且等于最内层电子数的整数倍,关于R的叙述中正确的是( )
A.常温下,能稳定存在的R的氧化物都是酸性氧化物
B.R的气态氢化物的水溶液具有强酸性
C.R是金属元素
D.R的气态氧化物不能在氧气中燃烧
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三第二轮训练三化学试卷(解析版) 题型:填空题
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1mol•L?1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O, 250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,其△H= kJ·mol?1。
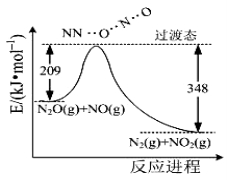
查看答案和解析>>
科目:高中化学 来源:2016届宁夏六盘山高中高三第四次模拟理综化学试卷(解析版) 题型:简答题
I.下列有关叙述正确的是( )
A.碱性锌锰电池中,MnO2是催化剂
B.银锌纽扣电池工作时,Ag2O被还原为Ag
C.放电时,铅酸蓄电池中硫酸浓度不断增大
D.电镀时,待镀的金属制品表面发生还原反应
II. 锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌.某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:

回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为______________。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的______________操作.
(3)浸出液“净化”过程中加入的主要物质为______________,其作用是______________。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是______________。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质.“氧压酸浸”中发生的主要反应的离子方程式为______________。
(6)我国古代曾采用“火法”工艺冶炼锌.明代宋应星著《天工开物》中有关“升炼倭铅”的记载:“炉甘石十斤,装载入一尼罐内,…,然后逐层用煤炭饼垫盛,其底铺薪,发火锻红,…,冷淀,毁罐取出,…即倭铅也.”该炼锌工艺主要反应的化学方程式为______________(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏六盘山高中高三第四次模拟理综化学试卷(解析版) 题型:选择题
下列表述不正确的是盐桥中的移向溶液
A | B | C | D |
|
|
|
|
盐桥中的Cl-移向ZnSO4溶液 | a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 | 粗铜的电极反应式为: Cu2++2e-=Cu | 正极反应式为: O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下期中化学试卷(解析版) 题型:填空题
氮是重要的非金属元素,单质用途之一是制取氨气,反应方程式为:
N2(g)+3H2(g)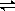 2NH3(g);回答下列问题:
2NH3(g);回答下列问题:
(1)氮元素在元素周期表的位置为______________,N2的结构式为______________
(2)在一个容积为2L的密闭容器中上述反应。反应开始时,各物质的量分别为:n(N2)=2mol,n(H2)=4mol,2min后n(H2)=1mol。
v表示反应速率,下列正确的是______________
A.2min末时n(NH3)=2.0molB.v(N2)=0.25mol·L-1·min-1
C.v(NH3)=1.0mol·L-1·min-1D.2min末时N2的浓度为0.5mol·L-1
(3)在350℃、30MPa下合成氨气时,n(NH3)和n(H2)(n表示物质的量)随时间变化的关系如下图所示,下列正确的是______________。
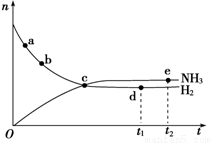
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,如果加入适当催化剂可以使该反应加快
(4)氮可以形成多种离子和分子,如N3-、NH2-、N2H4、N2H5+、N2H62+等,已知N2H5+、N2H62+是中性分子N2H4结合质子生成的,有与NH4+相似的性质。
①写出N2H5+与强碱反应的离子方程式为:______________。
②在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,两者反应生成两种不污染环境的物质。写出N2H4电子式______________,该反应的化学方程式为______________。
③写出与N3-电子数相等的一种分子的分子式______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列叙述错误的是( )
A.46gNO2和N2O4混合气体中含有原子总数为3NA
B.常温常压下,Cu-Zn原电池中,正极产生1.12LH2时,转移的电子数应小于0.1NA
C.12g金刚石中含有的共价键数为2NA
D.2.1gDTO中所含中子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com