
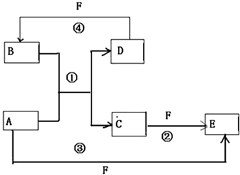
 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出) .反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O
.反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O分析 (1)若A为短周期金属单质,D为短周期非金属单质,A+B=C+D是置换反应,F的浓溶液与A、D反应都有红棕色气体生成,说明生成的气体为NO2,F为浓硝酸HNO3,非金属判断D为C,结合置换反应和所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,分析判断A为Mg,B为CO2,C为MgO,E为Mg(NO3)2;依据分析判断出的物质回答问题;
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行,D和F单质化合反应生成B为酸,则推断变价金属为Fe,B为HCl,D为H2,F为Cl2,E为FeCl3,反应②在水溶液中进行反应,其离子方程式是:2Fe2++Cl2═2Fe3++2Cl-;光照条件下D(H2)与F(Cl2)反应生成B(HCl);依据判断物质回答问题;
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,A+B=C+D是置换反应,依据周期表中非金属单质发生置换反应可知A为C,D为Si,F为O2,依据判断物质回答.
解答 解:(1)若A为短周期金属单质,D为短周期非金属单质,A+B=C+D是置换反应,F的浓溶液与A、D反应都有红棕色气体生成,说明生成的气体为NO2,F为浓硝酸HNO3,非金属判断D为C,结合置换反应和所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,分析判断A为Mg,B为CO2,C为MgO,E为Mg(NO3)2;A为Mg原子结构示意图为: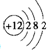 ;反应④是碳和浓硝酸加热反应生成二氧化氮和二氧化碳气体及水的反应,化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
;反应④是碳和浓硝酸加热反应生成二氧化氮和二氧化碳气体及水的反应,化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为: ;C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
;C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行,D和F单质化合反应生成B为酸,则推断变价金属为Fe,B为HCl,D为H2,F为Cl2,E为FeCl3,反应②在水溶液中进行反应,其离子方程式是:2Fe2++Cl2═2Fe3++2Cl-;光照条件下D(H2)与F(Cl2)反应生成B(HCl),化学方程式为:H2+Cl2$\frac{\underline{\;光照\;}}{\;}$2HCl,
故答案为:2Fe2++Cl2═2Fe3++2Cl-,H2+Cl2$\frac{\underline{\;光照\;}}{\;}$2HCl
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,A+B=C+D是置换反应,依据周期表中非金属单质发生置换反应可知A为C,D为Si,F为O2,反应①是碳置换硅的反应,化学方程式为为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:C,2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
点评 本题考查了物质转化的分析判断,物质性质的应用,反应特征的判断,题干条件的分析应用、置换反应的常见类型是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:1 | B. | 5:1 | C. | 7:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
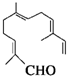 ,能与该化合物中所有官能团都发生反应的试剂有( )
,能与该化合物中所有官能团都发生反应的试剂有( )| A. | 酸性KMnO4溶液 | B. | Ag(NH3)2OH溶液 | C. | 新制Cu(OH)2悬浊液 | D. | H2/Ni |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热Al2O3 | B. | 加热HgO | C. | 电解熔融NaCl | D. | 铝粉和Fe2O3共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
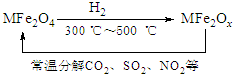
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸钠与工农业生产、生活紧密相关,工业硫酸钠大多采用侯氏制碱法制取.
硫酸钠与工农业生产、生活紧密相关,工业硫酸钠大多采用侯氏制碱法制取.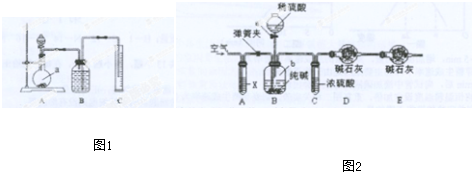
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.8 mol/(L•s) | B. | v(B2)=3mol/(L•min) | C. | v(C)=0.6 mol/(L•s) | D. | v(A2)=0.4 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积分数为95%的酒精通常作为医用酒精 | |
| B. | 石油的分馏、煤的气化、海水的提镁都包含化学变化 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 利用高纯度硅制造的太阳能电池板可将光能直接转化为电能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com