
| A. | 在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H2CO3)+c(H+) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
分析 A.碳酸氢根离子的水解程度对应其电离程度,则c(H2CO3)>c(CO32-);
B.根据碳酸钠溶液中的质子守恒判断;
C.反应后溶质为等浓度的碳酸钠和碳酸氢钠,碳酸根离子的水解程度较大,则c(HCO3-)>c(CO32-);
D.当醋酸钠与醋酸的浓度相等时,溶液呈酸性,若为中性,则醋酸浓度较小,即c(CH3COO-)>c(CH3COOH),结合电荷守恒判断.
解答 解:A.在0.1mol•L-1NaHCO3溶液中,HCO3-的水解程度对应其电离程度,则c(H2CO3)>c(CO32-),溶液中正确的离子浓度大小为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故A错误;
B.根据0.1mol•L-1Na2CO3溶液中的质子守恒可知:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+),故B错误;
C.向0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液,碳酸氢钠过量,反应后溶质为等浓度的碳酸钠和碳酸氢钠,由于CO32-的水解程度较大,则c(HCO3-)>c(CO32-),正确的离子浓度大小为:c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误;
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1],混合液呈中性,则:c(Na+)=c(CH3COO-)、c(H+)=c(OH-),醋酸钠溶液呈弱碱性,若为中性,则需要加入少量的醋酸,所以c(CH3COO-)>c(CH3COOH),溶液中正确的离子浓度大小为:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理的影响因素为解答关键,注意掌握电荷守恒、质子守恒、物料守恒的含义及应用,试题侧重考查学生的分析、理解能力及灵活应用能力.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的重要原料 | |
| B. | 用瓷坩埚加热熔化氢氧化钠固体 | |
| C. | 向BaCl2溶液中通入SO2,溶液不变浑浊,再入CO2,溶液仍不变浑浊 | |
| D. | 氧化铝是冶炼金属铝的原料,也是比较好的耐火材料,可用来制造耐火坩埚、耐火管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
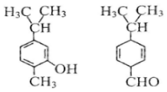
| A. | 不是同分异构体 | |
| B. | 分子中共平面的碳原了数相同 | |
| C. | 含氧官能团的性质不同 | |
| D. | 可用红外光谱区分,但不能用核磁共振氢谱区分 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
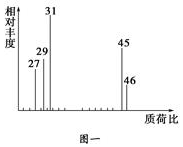
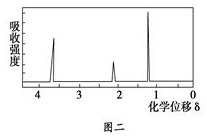
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
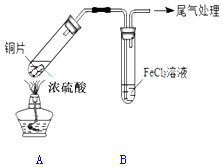 某校化学兴趣小组用如图装置进行SO2与FeCl3溶液的反应
某校化学兴趣小组用如图装置进行SO2与FeCl3溶液的反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向反应后的深蓝色溶液中加入乙醇,会有蓝色的CuSO4•5H2O晶体析出 | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| C. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的数目不变 | |
| D. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com