
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCL3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
| 60mol |
| 20mol |
| ||
| 50s |
| 0.8mol |
| 2.0L |
| 0.2mol |
| 2.0L |
| c(PCl3)?c(Cl2) |
| c(PCl5) |
| 0.1×0.1 |
| 0.4 |
| a+0.1 |
| 2 |
| ||
| 0.2 |
| x |
| 3 |
| 4 | 4.2×10-16 |
| 4 | 4.2 |
| 1.8×10-10 |
| 1.8 |
| 4 | 4.2 |
| 60mol |
| 20mol |


科目:高中化学 来源: 题型:
| A、每生成1mol Na2Mn5O10转移2mol电子 |
| B、AgCl是还原产物 |
| C、Na+不断向“水”电池的负极移动 |
| D、正极反应式:Ag+Cl--e-=AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
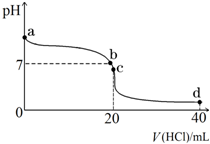 室温下,将0.1mol?L-1盐酸滴入20mL 0.1mol?L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.
室温下,将0.1mol?L-1盐酸滴入20mL 0.1mol?L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,pH=2的酸溶液与pH=12的强碱溶液等体积混合,所得溶液pH≤7 |
| B、某溶液中加入稀盐酸产生无色气体,将该气体通入澄清石灰水中变混浊,原溶液中一定含有大量CO32-或SO32- |
| C、某试液中加入盐酸酸化的氯化钡溶液,有白色沉淀,该溶液中一定含有SO42- |
| D、0.1mol/L弱酸HA溶液与 0.05mol/LNaOH溶液等体积混合后,所得溶液微粒浓度是2c(H+)+c(HA)=c(A-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L O3含有分子的数目为NA |
| B、常温常压下,4.0gCH4中含有共价键的数目为NA |
| C、电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜 |
| D、标准状况下,2.24LC12与过量NaOH溶液反应,转移电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在反应KIO3+6HI═KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA |
| B、电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜 |
| C、向仅含0.2molFeI2的溶液中持续通入氯气,当有0.1molFe2+被氧化时,转移电子的数目为0.5NA |
| D、将100 mL0.1mol?L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com