
| A. | 122.5 g KClO 3中含Cl-数目为NA | |
| B. | 1 mol/L的NaOH溶液中含Na+数目为NA | |
| C. | 标准状况下,22.4 L水中含氢原子数目为2NA | |
| D. | 常温常压下,32 g S03中含氧原子数目为1.2NA |
分析 A.氯酸钾电离出钾离子和氯酸根离子,不会电离出氯离子;
B.缺少溶液体积,无法计算溶液中含有钠离子数目;
C.标准状况下,水的状态不是气体;
D.根据n=$\frac{m}{M}$计算出三氧化硫的物质的量,然后可得出氧原子的物质的量及数目.
解答 解:A.KClO3在溶液中电离出K+和ClO3-,不会电离出Cl-,故A错误;
B.没有告诉1 mol/L的NaOH体积,无法计算氢氧化钠的物质的量,故B错误;
C.标况下水不是气体,不能使用标况下的气体摩尔体积计算,故C错误;
D.32g SO3的物质的量为:$\frac{32g}{80g/mol}$=0.4mol,含有O原子的物质的量为:0.4mol×3=1.2mol,含氧原子数目为1.2NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题侧重考查学生的化学计算能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、Cl-、OH- | B. | H+、Na+、CO32-、NO3- | ||
| C. | Cu2+、K+、SO42-、NO3- | D. | Na+、H+、OH-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐的电离平衡被破坏 | B. | 溶液温度升高 | ||
| C. | 25℃,溶液的pH不是7 | D. | 水的电离平衡被破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯锌与稀硫酸反应时,加少量CuSO4溶液,可使反应速率加快 | |
| B. | 甲烷和氧气以及KOH溶液构成的新型燃料电池中,负极上发生的反应为CH4+8OH-+8e-═CO2+6H2O | |
| C. | 把铜片和铁片紧靠在一起浸入稀H2SO4中,铁片表面出现气泡 | |
| D. | 把铜片插入FeCl3溶液中,在铜片表面出现一层铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物是乙醇和过量的3mol/L硫酸的混和液 | |
| B. | 温度计插入反应溶液液面以下,以便控制温度在140℃ | |
| C. | 反应容器(烧瓶)中应加入少许瓷片 | |
| D. | 反应完毕先灭火再从水中取出导管 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
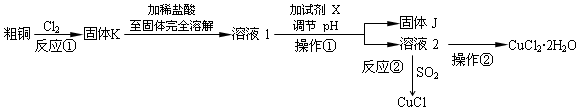
| 平行次数 | 1 | 2 | 3 |
| 0.250g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
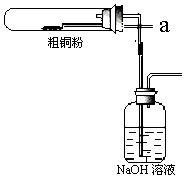
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com