
| A. | CH2═CH2+ (过氧乙酸)→ (过氧乙酸)→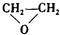 +CH3COOH +CH3COOH | |
| B. | CH2═CH2+Ca(OH)2→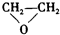 +CaCl2+H2O +CaCl2+H2O | |
| C. | 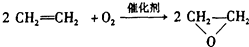 | |
| D. |  |
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题
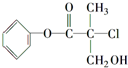 某有机物A是农药生产中的一种中间体,其结构简式如图所示.
某有机物A是农药生产中的一种中间体,其结构简式如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两原子N层上都有1个s电子,一个原子无d电子,另一个原子有d电子 | |
| B. | 两原子其核外全部都是s电子 | |
| C. | 最外层电子排布为2s22p5的原子和最外层电子排布为2s22p6的离子 | |
| D. | 原子核外M层上的s、p能级都充满电子,而d能级上没有电子的两种原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在元素周期表中,主族元素所在的族序数等于原子核外电子数 | |
| B. | 元素周期表有18个族 | |
| C. | ⅠA族的元素不全都是金属元素 | |
| D. | 短周期指的是一、二、三、四周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
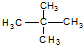 和
和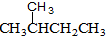 ⑧CH4和CH3CH3
⑧CH4和CH3CH3查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前2 s 的平均速率v(CO)=0.080mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(Cl2)=“0.11“mol•L-1,则反应的△H<0 | |
| C. | T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,反应达到平衡前v正>v逆 | |
| D. | T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 装置图 |  |  | 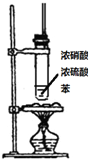 | 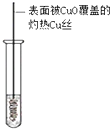 |
| 实验目的 | 分离乙酸乙酯、碳酸钠和水的混合物 | AgNO3验证苯与液溴发生取代反应 | 制备硝基苯 | 验证乙醇的还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
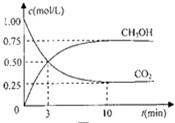 甲醇(CH3OH)是一种优质燃料,
甲醇(CH3OH)是一种优质燃料,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com