
【题目】在如图用石墨作电极的电解池中,放入500mL含—种溶质的某蓝色硫酸盐溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成。请回答下列问题:
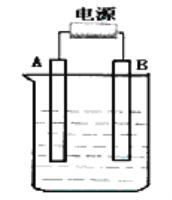
(1)写出电解时反应的总离子方程式____________________。
(2)若当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重6g。电解后溶液的pH为_____________。要使电解后溶液恢复到电解前的状态,则需加入_____________,其质量为_____________g。(假设电解前后溶液的体积不变)
(3)若原溶液为1L K2SO4、CuSO4的混合溶液,且c (SO42-) =2.0mol/L;如图装置电解,当两极都收集到22.4L气体(标准状况)时,停止电解。则原溶液中的c(K+)=_____________。
【答案】2Cu2++2H2O![]() 2Cu+O2↑+4H+ pH=l CuO (或 CuCO3) 2 (或 3.1) c(K+) =2moI/L
2Cu+O2↑+4H+ pH=l CuO (或 CuCO3) 2 (或 3.1) c(K+) =2moI/L
【解析】
(1)根据实验现象判断A、B的电极名称,并写出电极反应式及电池反应式;
(2)根据电池反应式中铜与氢离子的关系式计算氢离子的物质的量,从而确定溶液的pH值;根据电池反应式电解出的物质判断并计算析出物质的质量;
(3)根据电解时阴阳极上得失电子守恒计算铜的物质的量,从而算出铜离子的浓度,根据溶液中阴阳离子的电荷守恒计算钾离子的浓度。
电解硫酸盐时,溶液中氢氧根离子放电能力大于硫酸根离子,所以在阳极上析出氧气,根据实验现象判断,在阴极上析出铜,所以B极是阳极;阳极上氢氧根离子失电子生成水和氧气,电极反应式为4OH--4e-=2H2O+O2↑;根据实验现象知,溶液中铜离子得电子变成铜单质析出,氢氧根离子失电子变成水和氧气,所以其电池反应式为2Cu2++2H2O![]() 2Cu+O2↑+4H+,
2Cu+O2↑+4H+,
故答案为:2Cu2++2H2O![]() 2Cu+O2↑+4H+。
2Cu+O2↑+4H+。
(2)2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
128g 4mol
1.6g 0.05mol
c(H+)=0.05mol÷0.5L=0.1mol/L,故pH=1;
取出A电极,洗涤、干燥、称量、电极增重1.6g,这说明析出的铜质量是1.6g,物质的量是0.025mol,要使电解后溶液恢复到电解前的状态,则需加入CuO或CuCO3,其质量为0.025mol×80g/mol=2.0g或0.025mol×124g/mol=3.1g,
故答案为:pH=1;CuO或CuCO3;2或3.1。
(3)电解时阳极上析出氧气,阴极上析出氢气和铜,22.4L气体的物质的量为1mol,根据电解时阴阳极上得失电子守恒,列关系式为:n(H2)×2+n(Cu)×2=n(O2)×4,1mol×2+n(Cu)×2=1mol×4,n(Cu)=1mol,故c(Cu2+)=1mol/1mol/L,
根据溶液中阴阳离子的电荷守恒列关系式为:c(Cu2+)×2+c(K+)×1=c(SO42-)×2,所以c(K+)=2mol/L,
故答案为:2mol/L。


科目:高中化学 来源: 题型:
【题目】人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,某化学兴趣小组利用如图装置制备氨气并探究相关性质。

(1)装置A 中,盛有浓氨水的仪器名称为_____。装置B 的作用是_____。
(2)连接好装置并检验装置的气密性后,装入药品,然后应先_____(填 I 或Ⅱ)。
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水 Ⅱ.加热装置C
(3)实验中观察到C 中 CuO 粉末变红,D 中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为_____,该反应证明氨气具有还原性;氨与氧气的在催化剂作用下的反应也体现了这一性质,该反应化学方程式为_____。
(4)该实验缺少尾气吸收装置,如图中能用来吸收尾气的装置是_____(填装置序号)。

(5)实验室还可用如图所示装置制备氨气,化学反应方程式为_____。

(6)现将 1.92gCu 投入到一定量的浓HNO3 中,Cu 完全溶解,生成气体颜色越来越浅,共收集到标准状况下 672mL 的NOX 混合气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入标准状况下的 O2 的体积为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物的合成与结构修饰是制备具有特殊功能材料的重要过程。如图是合成具有特殊功能高分子材料W( )的流程:
)的流程:

已知:
I. ![]() R-CH2OH
R-CH2OH
II. ![]() =R2-OH
=R2-OH![]() ,R、R2、R3代表烃基
,R、R2、R3代表烃基
(1)①的反应类型是___________。
(2)②是取代反应,其化学方程式是____________________。
(3)D的核磁共振氢谱中有两组峰且面积之比是1∶3,不存在顺反异构。D的结构简式是_______。
(4)⑤的化学方程式是_________________。
(5)F的官能团名称____________________;G的结构简式是____________________。
(6)⑥的化学方程式是_________________________。
(7)符合下列条件的E的同分异构体有__________种(考虑立体异构)。
①能发生水解且能发生银镜反应 ②能与Br2的CCl4溶液发生加成反应
其中核磁共振氢谱有三个峰的结构简式是__________________。
(8)工业上也可用 合成E。由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件,
合成E。由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件,![]() 不易发生取代反应)
不易发生取代反应)
![]() _______________。
_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2其原理如图所示,正确的是( )

A.通电后,H+通过质子交换膜向右移动,最终右侧溶液pH减小
B.电源A极为负极
C.通电后,若有22.4LH2生成,则转移0.2mol电子
D.与电源A极相连的惰性电极上发生的反应为CH3COOH-8e-+2H2O=CO2↑+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量干燥的氨气,所用下列装置、药品等正确的是
A.①是氨气发生装置 B.②是氨气发生装置
B.②是氨气发生装置
C.③是氨气收集、检验装置 D.④是氨气吸收装置
D.④是氨气吸收装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是一种重要的化工原料,目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题。
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:___。
(2)写出“联合制碱法”中有关反应的化学方程式:_____________、___________。
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?________。
(4)“联合制碱法”是对“氨碱法”的改进,其相对优点有___________ (填字母序号)。
A. 提高了原料利用率
B. 降低了生产成本
C. 减少了环境污染
D. 减轻了对设备的腐蚀
(5)产品纯碱中常含有碳酸氢钠,如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,已知所取产品的质量为m1g,加热后所剩固体的质量为m2g,则纯碱中碳酸氢钠的质量分数可表示为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示在没有通风橱时制取纯净的氯气时设计的装置图,图中A、B是可控制的弹簧铁夹。
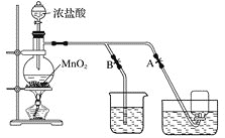
(1)烧杯中盛放的液体是__________,其作用是_________,水槽中盛放的液体是_________。
(2)简述操作过程:(从氯气已经产生开始)在收集氯气之前,应__________________________;当氯气纯度合乎要求时,应__________________________________,当氯气收集完毕时,应______。
(3)将8.7 g二氧化锰与含氯化氢14.6 g的浓盐酸共热制氯气,甲同学认为可制得氯气 7.1 g,乙同学认为制得氯气的质量小于7.1 g,你认为________(填“甲”或“乙”)同学正确,原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 将溴乙烷和氢氧化钠的乙醇溶液共热后产生的气体通入溴的四氯化碳溶液,溶液褪色 | 溴乙烷发生消去反应 |
C |
|
|
D | 向 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质![]() 有下图所示转化关系(部分反应物、生成物未列出)。其中
有下图所示转化关系(部分反应物、生成物未列出)。其中![]() 为某金属矿的主要成分,经过一系列反应可得到气体
为某金属矿的主要成分,经过一系列反应可得到气体![]() 和固体
和固体![]() 。单质
。单质![]() 可与
可与![]() 的浓溶液发生反应,
的浓溶液发生反应,![]() 为砖红色沉淀。
为砖红色沉淀。

请回答下列问题:
(1)写出下列物质的化学式:![]() ______、
______、![]() ______。
______。
(2)反应②的化学方程式是__________________________________________。
(3)利用电解可提纯![]() 物质,现以碱性锌锰电池为外电源,在该电解反应中电解质溶液是_________,阳极物质是____________。
物质,现以碱性锌锰电池为外电源,在该电解反应中电解质溶液是_________,阳极物质是____________。![]() 是碱性锌锰电池的正极材料,电池放电时,正极的电极反应式为________。
是碱性锌锰电池的正极材料,电池放电时,正极的电极反应式为________。
(4)将![]() 和
和![]() 充入一个固定容积为
充入一个固定容积为![]() 的密闭容器中, 在一定温度并有催化剂存在下,进行反应①,经半分钟后达到平衡,测得容器中含
的密闭容器中, 在一定温度并有催化剂存在下,进行反应①,经半分钟后达到平衡,测得容器中含![]() ,则
,则![]() ____________
____________![]() ;若温度不变,继续通入
;若温度不变,继续通入![]() 和
和![]() ,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______
,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______![]() ______
______![]() 。
。
(5)写出![]() 转化过程中,甲醛参与反应的化学方程式: ____________。
转化过程中,甲醛参与反应的化学方程式: ____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com