
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
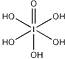 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)分析 (1)根据基态原子核外电子排布式中最后填入电子名称确定区域名称,溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子;
(2)根据氢键分析解答;
(3)元素的第一电离能越大,元素失电子能力越弱,得电子能力越强,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子;
(4)根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;
(5)根据价层电子对互斥理论来确定其杂化方式,价层电子对个数=σ键个数+孤电子对个数;
(6)等电子体是具有相同的价电子数和相同原子数的微粒.
解答 解:(1)解:根据构造原理知,卤族元素最后填入的电子为p电子,所以卤族元素位于元素周期表的p区;溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,所以其价电子排布式为4s24p5,故答案为:p;4s24p5;
(2)HF分子之间存在氢键,使氢氟酸分子缔合,故答案为:氢键;
(3)卤族元素包含:F、Cl、Br、I、At元素,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子,根据表中数据知,卤族元素中第一电离能最小的是I元素,则碘元素易失电子生成简单阳离子,故答案为:I;
(4)H5IO6(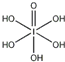 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有2个羟基氢,含非羟基氧原子2个,所以酸性:H5IO6<HIO4,
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有2个羟基氢,含非羟基氧原子2个,所以酸性:H5IO6<HIO4,
故答案为:<;
(5)ClO2-中心氯原子的价层电子对数n=2+$\frac{7+1-2×2}{2}$=4,属于sp3杂化,故答案为:sp3;
(6)等电子体具有相同的电子数目和原子数目的微粒,所以与ClO2-互为等电子体的分子为Cl2O、OF2等,故答案为:Cl2O或OF2.
点评 本题考查物质结构与性质,题量较大,比较综合,涉及元素周期表、核外电子排布、分子结构与性质、电离能、杂化轨道、等电子体等,侧重对主干知识的考查,需要学生熟练掌握基础知识,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 25°C,1.01×105Pa,64gSO2中含有的原子数为3NA | |
| C. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| D. | 标准状况下,11.2LH2O含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ②③④⑤⑨⑩ | C. | ②④⑤⑩ | D. | ②④⑤⑥⑦⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:1 | B. | 5:1 | C. | 3:1 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子占核外电子总数的$\frac{3}{8}$ |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-) | |
| B. | V[C6H5OH(aq)]=20mL时,c(C6H5O-)+c(C6H5OH)=2c(K+) | |
| C. | pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-) | |
| D. | V[C6H5OH(aq)]=10mL时,c(K+)=c(C6H5O-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①③②④ | C. | ④③②① | D. | ②③④① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com