
(08年天津卷)(19分)Ⅰ,(8分)化学实验室制取氯化氢气体的方法之一是将浓硫酸滴入浓盐酸中。请从下图中挑选所需仪器,在方框内画出用该方法制备、收集干燥氯化氢气体的装置简图,并在图中标明所用试剂。(仪器可重复使用,固定装置不必画出)
Ⅱ,(11分)实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%-30%的稀硫酸溶液,在50℃-80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集产品。
(1)写出该实验制备硫酸亚铁的化学方程式:____________ 。
(2)硫酸溶液过稀会导致_____________ 。
(3)采用水浴加热的原因是______________ 。
(4)反应时铁屑过量的目的是(用离子方程式表示)___________ 。
(5)溶液趁热过滤的原因是_______________ 。
塞紧试管口的目的是______________ 。
(6)静置冷却一段时间后,在试管中观察到的现象是_____________ 。
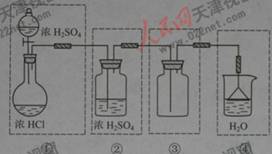
I解析:浓硫酸和浓盐酸反应制取HCl气体,不需要加热,即:液+液![]() 气,可采用分液漏斗和圆底烧瓶组成发生装置;干燥HCl可以装有浓硫酸的洗瓶,收集HCl用向上排空气法,由于HCl气体极易溶于水,故在水面用倒扣的漏斗来吸收尾气。整个装置为:
气,可采用分液漏斗和圆底烧瓶组成发生装置;干燥HCl可以装有浓硫酸的洗瓶,收集HCl用向上排空气法,由于HCl气体极易溶于水,故在水面用倒扣的漏斗来吸收尾气。整个装置为:
Ⅱ【解析】⑴铁和稀硫酸反应的方程式为:Fe+H2SO4(稀)![]() FeSO4+H2↑。
FeSO4+H2↑。
(2)硫酸如果浓度过稀,则反应时速率过慢;另外由于溶液中含有较多的水,也不利于硫酸亚铁晶体的析出。
(3)水浴加热受热均匀,温度容易控制。
(4)铁屑过量的目的是防止Fe2+被氧化成Fe3+,即使被氧化Fe可以使Fe3+还原:Fe+2Fe3+=3Fe2+。
(5)溶液趁热过滤的目的是减少FeSO4的损失;塞紧试管口的目的是防止空气中的氧气将FeSO4氧化。
(6)硫酸亚铁热溶液在冷却过程中,溶解度降低,在静止冷却一段时间后会有浅绿色硫酸亚铁晶体析出。
答案: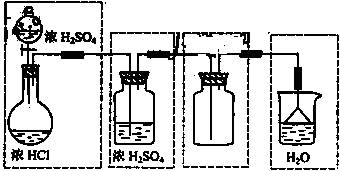
(1)Fe+H2SO4(稀)![]() =FeSO4+H2↑
=FeSO4+H2↑
(2)反应速率慢 不利于晶体析出
(3)(4)Fe3++2Fe=3Fe2+
(5)减少FeSO4的损失
防止空气进入试管将Fe2+氧化为Fe3+
(6)有浅绿色晶体析出


科目:高中化学 来源: 题型:
(08年天津卷)二十世纪化学合成技术的发展对人类健康水平和生活质量的提高做出了巨大贡献。下列各组物质全部由化学合成得到的是()
A. 玻璃 纤维素 青霉素 B. 尿素 食盐 聚乙烯
C. 涤沦 洗衣粉 阿斯匹林 D. 石英 橡胶 磷化铟
查看答案和解析>>
科目:高中化学 来源: 题型:
(08年天津卷)对平衡 CO2(g)![]() CO2(aq) .△H=-19.75KJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是()
CO2(aq) .△H=-19.75KJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是()
A. 升温增压 B. 降温减压
C. 升温减压 D. 降温增压
查看答案和解析>>
科目:高中化学 来源: 题型:
A、醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B、0.10mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小
C、CH3COOH溶液中加入少量的CH3COONa固体,平衡逆向移动
D、常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
(08年天津卷) 下列离子方程式书写正确的是()
A. 石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓
B. NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH-![]() NH3Ÿ+SO32-+2H2O
NH3Ÿ+SO32-+2H2O
C. 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
D. AgNO3溶液中加入过量的氨水:Ag++NH3?H2O=AgOH +NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
(08年天津卷)(14分)W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为_____ 。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为______ 。
(3)X的硝酸盐水溶液显 ___ 性,用离子方程式解释原因_____ 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 ______ 。
(5)比较Y、Z气态氢化物的稳定性:_____ >_____ (用分子式表示)。
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:___ > ____ >____ > ___ 。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量。写出该反应的热化学方程式:___________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com