
(14分)有机物A((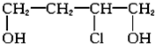 ))是合成高分子化合物HPMA的中间体,HPMA可用于制备锅炉阻垢剂。关于A有如下反应流程:
))是合成高分子化合物HPMA的中间体,HPMA可用于制备锅炉阻垢剂。关于A有如下反应流程:
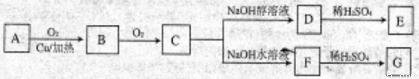
请回答下列问题:
(1)有机物A不能够发生的反应有:_________(填写字母)
A. 取代反应 B. 加成反应 C. 消去反应 D. 酯化反应
(2)可与1mol 有机物C反应的NaOH的物质的量最多可为___________
A. 1mol B. 2mol C. 3mol D. 4mol
(3)1mol A与E可在浓硫酸作用下脱去2mol H2O,写出该反应的化学方程式:________________;
(4)E在高温、高压和催化剂作用下反应生成高分子化合物HPMA,写出该反应的化学方程式:________;
(5)H是G的一种同分异构体。0.1mol H与足量金属Na反应放出3.36L氢气(标准状况下),0.1mol H足量NaHCO3反应放出2.24LCO2(标准状况下),H能发生银镜反应。H的结构简式可能是:____________、________________.
(1)B (2)C;
(3 )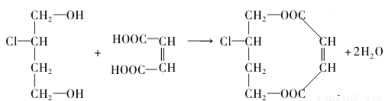 ;
;
(4)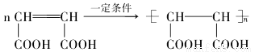 ;
;
(5)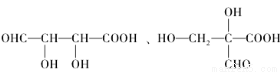
【解析】
试题分析:(1)由于在有机物A中含羟基,所以可以发生取代反应、酯化反应,由于在羟基连接的C原子的邻位C原子上有H原子或在Cl原子连接的C原子的邻位C原子上有H原子,所以可以发生消去反应,由于在物质的分子中无碳碳双键,所以不能发生加成反应。因此有机物A不能够发生的反应有B. 加成反应;(2)有机物A催化氧化得到B:OHC-CH2-CHCl-CHO;B再催化氧化得到C:HOOC-CH2-CHCl-COOH;在C的分子中含有两个羧基和一个Cl原子,因此可与1mol 有机物C反应的NaOH的物质的量最多可为3mol的NaOH,因此选项是C;(3)C与NaOH的乙醇溶液发生消去反应和酸碱中和反应产生D:NaOOC-CH=CH-COONa;D与稀硫酸发生反应产生E:HOOC-CH=CH-COOH;1mol A与E可在浓硫酸作用下脱去2mol H2O,该反应的化学方程式是: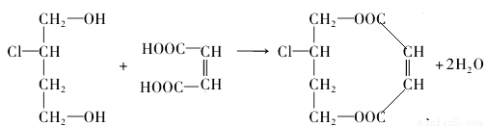 ;(4)E在高温、高压和催化剂作用下反应生成高分子化合物HPMA,该反应的化学方程式是:
;(4)E在高温、高压和催化剂作用下反应生成高分子化合物HPMA,该反应的化学方程式是: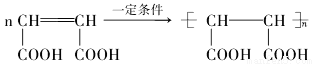 ;(5)C:HOOC-CH2-CHCl-COOH;与NaOH的水溶液发生取代反应和酸碱中和反应,产生F: NaOOC-CH2-CH(OH)-COONa;F与稀硫酸发生复分解反应产生G:HOOC-CH2-CH(OH)-COOH。H是G的一种同分异构体,0.1mol H与足量金属Na反应放出3.36L氢气(标准状况下),则H中含有三个羟基(包括醇羟基和羧基羟基),0.1mol H与足量NaHCO3反应放出2.24LCO2(标准状况下),则H中含有2个羧基和一个醇羟基,H能发生银镜反应,则H中含有醛基。H的结构简式可能是:
;(5)C:HOOC-CH2-CHCl-COOH;与NaOH的水溶液发生取代反应和酸碱中和反应,产生F: NaOOC-CH2-CH(OH)-COONa;F与稀硫酸发生复分解反应产生G:HOOC-CH2-CH(OH)-COOH。H是G的一种同分异构体,0.1mol H与足量金属Na反应放出3.36L氢气(标准状况下),则H中含有三个羟基(包括醇羟基和羧基羟基),0.1mol H与足量NaHCO3反应放出2.24LCO2(标准状况下),则H中含有2个羧基和一个醇羟基,H能发生银镜反应,则H中含有醛基。H的结构简式可能是: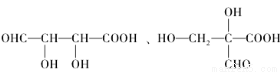 。
。
考点:考查有机物的结构、性质、转化、化学方程式、同分异构体的种类及书写的知识。


科目:高中化学 来源:2015届辽宁省高三上学期10月月考试卷(解析版) 题型:选择题
用某种仪器量取液体体积时,平视时读数为n mL,仰视时读数为 x mL,俯视时读数为y mL,若x>n>y,则所用的仪器可能为( )
A.量筒 B.容量瓶 C.滴定管 D.以上均不对
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省大连市高三10月月考理综化学试卷(解析版) 题型:选择题
1 L某混合溶液中,溶质X、Y浓度都为0.1mol·L—1,向混合溶液中滴加0.1 mol·L—1某溶液Z,所得沉淀的物质的量如图所示,则X、Y、Z分别是
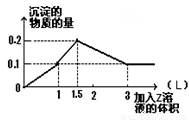
A.氯化铝、氯化镁、氢氧化钠 B.偏铝酸钠、氢氧化钡、硫酸
C.氯化铝、氯化铁、氢氧化钠 D.偏铝酸钠、氯化钡、硫酸
查看答案和解析>>
科目:高中化学 来源:2015届辽宁沈阳市高三上学期第一次模拟考试化学试卷(解析版) 题型:选择题
下列各组离子,能在指定溶液中共存的是
①无色溶液中:K+、Cl-、Na+、HCO3-、OH-
② 使pH试纸变深蓝色的溶液中: K+、CO32-、Na+、AlO2-
③水电离的c(H+)=10-12mol·L-1的溶液中:ClO-、HCO3-、NO3-、NH4+、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42-
⑤使甲基橙变红的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
⑥pH=0的溶液中:Fe2+、Al3+、NO3-、Cl-、SO32-
①③ B.②④⑤ C.①②⑤ D.③⑥
查看答案和解析>>
科目:高中化学 来源:2015届辽宁沈阳市高三上学期第一次模拟考试化学试卷(解析版) 题型:选择题
水溶液中能大量共存的一组离子是
A.Na+、Ca2+、Cl-、SO42- B.Fe2+、H+ 、SO32-、ClO-
C.Mg2+、NH4+、Cl- 、SO42- D.K+、Fe3+、NO3-、SCN-
查看答案和解析>>
科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:填空题
(6分)碳是形成化合物种类最多的元素。
(1)CH2=CH-C≡N是制备腈纶的原料,其分子中 键和
键和 键的个数之比为__________(填最简整数比);
键的个数之比为__________(填最简整数比);
(2)乙醇CH3CH2OH与甲醚CH3OCH3的分子式均为C2H6O,但CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是____________________;
(3)某元素位于第4周期VII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为_______________.
查看答案和解析>>
科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:选择题
已知25。C时,下表为几种常见物质的溶度积常数;下列有关说法不正确的是( )
化学式 | 溶度积常数 | 化学式 | 溶度积常数 |
Ag2S | 6.3×10-50 | AgCl | 1.8×10-10 |
CuS | 4.3×10-36 | AgBr | 5.4×10-13 |
FeS | 6.3×10-18 | AgI | 8.3×10-17 |
A.除去工业废水中的Cu2+可以选用Na2S作沉淀剂
B.将AgCl、AgBr和AgI饱和溶液等体积混合后,再加入足量的浓AgNO3溶液,首先析出AgI沉淀
C.Ag2S、CuS、FeS溶解度依次增大
D.将FeS加入较浓的CuSO4溶液中,会有CuS生成
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期第二次月考化学试卷(解析版) 题型:填空题
(16分) 已知2A2(g)+B2(g) 2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
(1)比较a b(填“>、=、<”)
(2)若将反应温度升高到700℃,该反应的平衡常数将 (填“增大”“减小”或“不变”)。若将反应容器的体积压缩,平衡向 方向移动(填“正反应”或”逆反应”),该反应的平衡常数将 。(填“增大”“减小”或“不变”)
(3)若在原来的容器中,只加入2 mol C3,500 ℃时充分反应达平衡后,吸收热量ckJ,C3的浓度也是w mol/L,则c 等于 (用a、b表示)。
(4)能说明该反应已经达到平衡状态的是
A 2v逆(A2)=v正(B2) B v正(C3)=2v正(B2)
C A2与C3浓度相等 D.混合气体的平均相对分子质量不变
E.容器内压强保持不变 F.容器内密度保持不变
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A2和1molB2,500 ℃时充分反应达平衡后,放出热量dkJ,则d b(填“>、=、<”)
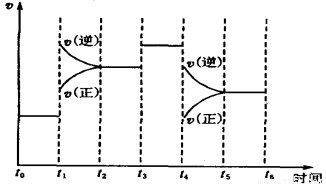
(7)下图表示此反应的反应速率v和时间t的关系图。
根据下图判断,在t1和t4时刻改变的外界条件分别是 和 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
对于反应①KHCO3溶液与石灰水反应;②Na2CO3 溶液与稀盐酸反应;③Na与烧碱溶液反应;④Fe与稀硝酸反应;改变反应物用量或浓度,不能用同一个离子方程式表示的是
A.①②③ B.①③④ C.①②④ D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com