
| A. | KCl的电子式: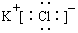 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 中子数为117,质子数为78 的铂原子:${\;}_{117}^{195}Pt$ | |
| D. | K+的结构示意图: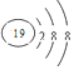 |
分析 A.KCl由钾离子和氯离子构成;
B.乙烯的结构简式中碳碳双键不能省略;
C.质量数A=质子数Z+中子数N,左下角为质子数;
D.K+的核电荷数为19,原子核外有3个电子层,最外层电子数为8.
解答 解:A.KCl由钾离子和氯离子构成,故电子式为: ,故A正确;
,故A正确;
B.乙烯的结构简式为:CH2=CH2,故B错误;
C.质量数A=质子数Z+中子数N,故铂原子的质量数为197,表示为19578Pt,故C错误;
D.K+的核电荷数为19,原子核外有3个电子层,最外层电子数为8,则离子的结构示意图为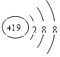 ,故D错误.
,故D错误.
故选A.
点评 本题考查了常见化学用语的表示方法判断,为高频考点,题目难度中等,注意掌握离子结构示意图、电子式、元素符号、结构式等化学用语的书写原则,明确离子结构示意图与原子结构示意图、离子化合物与共价化合物的电子式的区别,试题侧重考查学生的规范答题的能力.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液在电流作用下电离成Na+和Cl- | |
| B. | 溶于水后能够电离出H+的化合物都是酸 | |
| C. | 氯化氢溶于水形成的溶液能够导电,所以氯化氢是电解质 | |
| D. | CO2溶于水形成的溶液能够导电,所以CO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每消耗1molCH4可以向外电路提供4mole- | |
| B. | 在负极上O2获得电子,电极反应式为 O2+2H2O+4e-=4OH- | |
| C. | 外电路电子由负极流向正极,内电路电子由正极流向负极 | |
| D. | 电池放电过程中,溶液的PH不断降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液中加稀盐酸入:HCO3-+H+═CO2↑+H2O | |
| B. | 碳酸钡和稀硝酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | 铜片插入硝酸银溶液:Cu+Ag+═Cu2++Ag | |
| D. | 把金属铁放入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢是强电解质,醋酸是弱电解质,盐酸溶液的导电性一定强于醋酸溶液 | |
| B. | 不论是浓硝酸还是稀硝酸,与铜反应均体现出硝酸的酸性和强氧化性 | |
| C. | SO2、NO、NO2都是形成酸雨的因素,都能和水反应生成酸 | |
| D. | 氯元素的非金属性强于碳元素,氯元素含氧酸的酸性都大于碳元素的含氧酸的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的电子式: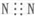 | |
| B. | S2-的结构示意图: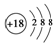 | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{58}^{131}$I | |
| D. | 乙烯的分子式:CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1氯化钠溶液 | B. | 75 mL 2 mol•L-1氯化铵溶液 | ||
| C. | 150 mL 1 mol•L-1氯化钾溶液 | D. | 75 mL 1 mol•L-1氯化铝溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
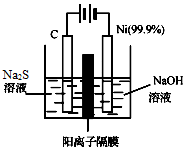 硫及其化合物广泛分布于自然界中,硫酸工业在国民经济中占有极其重要的地位,运用相关原理回答下列问题:
硫及其化合物广泛分布于自然界中,硫酸工业在国民经济中占有极其重要的地位,运用相关原理回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com