
分析 (1)金属性越强,与水反应越剧烈;
(2)与水反应最剧烈的非金属性最强;
(3)在室温下有颜色的气体单质是氟气和氯气;.
(4)在空气中容易自燃的单质名称是白磷;.
(5)除稀有气体元素外,原子半径最大的元素是 钠,主族序数等于电子层数2倍的元素是碳和硫;
(6)同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大;
(7)气态氢化物的水溶液呈碱性的元素是N;
(8)元素的非金属性越强,对应的氢化物越稳定;
(9)最高价氧化物对应的水化物酸性最强的元素是Cl;碱性最强的元素是 Na;
(10)15号元素原子核外有3个电子层,最外层电子数为5;第二周期第IVA族的元素是C.
解答 解:(1)与水反应最剧烈的金属单质是钠,故答案为:Na;
(2)与水反应最剧烈的非金属单质是氟,故答案为:F2;
(3)在室温下有颜色的气体单质是氟气和氯气,分别为浅黄绿色和黄绿色故答案为:F2、Cl2;
(4)在空气中容易自燃的单质名称是白磷,故答案为:P;
(5)除稀有气体元素外,原子半径最大的元素是 钠,主族序数等于电子层数2倍的元素是碳和硫,故答案为:C、S;
(6)原子半径最小的元素是 H,同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,其次是F,故答案为:H;F;
(7)气态氢化物的水溶液呈碱性的元素是N,故答案为:N;
(8)F的非金属性最强,则最稳定的气态氢化物的化学式是HF,故答案为:HF;
(9)最高价氧化物对应的水化物酸性最强的元素是Cl,则HClO4酸性最强;碱性最强的元素是 Na,NaOH碱性最强,故答案为:HClO4、NaOH;
(10)15号元素原子核外有3个电子层,最外层电子数为5,位于周期表第三周期ⅤA族,第二周期第IVA族的元素是C,原子序数为6,故答案为:第三周期ⅤA族;6.
点评 本题考查元素周期律,比较基础,为高频考点,侧重于学生的分析能力的考查,侧重对基础知识的巩固,掌握金属性与非金属性强弱比较及实验事实.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有③④ | C. | 只有①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.01×105Pa,20℃时48g O3含有的分子数为NA | |
| B. | 1molNa2O2晶体中阴离子数为2 NA | |
| C. | 标准状况下,33.6L的 乙醇(C2H5OH)中含有的碳原子数目为3NA | |
| D. | 常温常压下,7.1 g Cl2与足量的Fe充分反应,转移的电子数目为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含四种元素的原子半径由小到大的顺序为:H<O<N<C | |
| B. | 同周期的三种元素的得电子能力由大到小的顺序为:O>N>C | |
| C. | 与足量烧碱溶液共热的离子方程式为:NH4++OHˉ$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 除去NaCl固体中混有少量的NH4HCO3固体可以采用加热的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
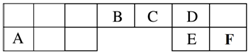 短周期元素(前18号元素)A、B、C、D、E、F在元素周期表中的位置如图所示,其中D为地壳中含量最高的元素.
短周期元素(前18号元素)A、B、C、D、E、F在元素周期表中的位置如图所示,其中D为地壳中含量最高的元素. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
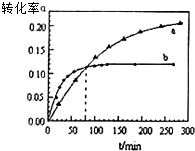 丙酮(CH3COCH3)可作为合成聚异戊二烯橡胶,环氧树脂等物质的重要原料,丙酮在某溶剂里在催化剂作用下发生反应:2CH3COCH3(aq)?CH3COCH2COH(CH3)2(aq).回答下列问题
丙酮(CH3COCH3)可作为合成聚异戊二烯橡胶,环氧树脂等物质的重要原料,丙酮在某溶剂里在催化剂作用下发生反应:2CH3COCH3(aq)?CH3COCH2COH(CH3)2(aq).回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com