
COCl2(g)CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.①④⑥ C.②③⑤ D.③⑤⑥
科目:高中化学 来源: 题型:
实验室中需要22.4 L(标准状况)SO2气体。化学小组同学依据化学方程式Zn+2H2SO4(浓)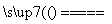 ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1)化学小组所制得的气体中混有的主要杂质气体可能是______(填分子式)。产生这种结果的主要原因是________(用化学方程式和必要的文字加以说明)。
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。
①装置B中加入的试剂为________,作用是________。
②装置D加入的试剂为________________,装置F加入的试剂为________________。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是________。
④U形管G的作用为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。回答下列问题:
| m | n | ||
| x | y |
(1)元素x在周期表中的位置是______周期第______族,其单质可采用电解熔融__________的方法制备。
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是__________,碱性最强的是______________。(填化学式)
(3)气体分子(mn)2的电子式为__________。(mn)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
依据下列甲、乙、丙三图,判断下列叙述不正确的是( )
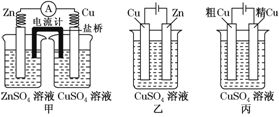
A.甲是原电池,乙是电镀装置
B.甲、乙装置中,锌极上均发生氧化反应
C.乙、丙装置中,阳极均发生氧化反应而溶解
D.乙、丙装置中,c(Cu2+)基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是_________________________________________________________________
(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的________。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为________。取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是______________________________________________
_______________________________________________________________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是_______________________________________________________________。
(3)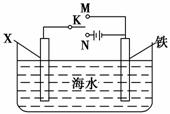 利用右图装置,可以模拟铁的电化学防护。
利用右图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应置于________处。若X为锌,开关K置于M处,该电化学防护法称为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在等温等容条件下,可逆反应:2A(g)+B(g)3C(g)+D(s)起始物质的量如下表所示:
| 序号 | A | B | C | D |
| ① | 2 mol | 1 mol | 0 | 0 |
| ② | 4 mol | 2 mol | 0 | 0 |
| ③ | 1 mol | 0.5 mol | 1.5 mol | 0.5 mol |
| ④ | 0 | 1 mol | 3 mol | 1 mol |
| ⑤ | 0 | 0 | 3 mol | 1 mol |
上述反应达到平衡时,互为等效平衡的是哪几组?达到平衡后,哪些量相同?
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下( )
A.加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,体积为1 L的密闭容器中发生如下反应:
SiF4(g)+2H2O(g)SiO2(s)+4HF(g)
ΔH=148.9 kJ·mol-1。
(1)下列各项中能说明该反应已达化学平衡状态的是__________(填字母)。
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示。
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
通过a或b的值及化学平衡原理说明t1时反应是否达到化学平衡状态:__________。
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应________(填字母)。
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是减小压强造成的
d.一定是升高温度造成的
e.SiF4的平衡转化率一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
有关Na2CO3和NaHCO3的性质,下列叙述中错误的是( )
A.相同温度下,等浓度的Na2CO3溶液和NaHCO3溶液的碱性比较,前者更强
B.常温时水溶性:Na2CO3>NaHCO3
C.在酒精灯加热的条件下,前者不分解,后者分解
D.将澄清的石灰水分别加入Na2CO3和NaHCO3溶液中,前者产生沉淀,后者不产生沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com