
| A. | F-的结构示意图: | B. | CO2的分子模型示意图: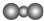 | ||
| C. | N2的结构式::N≡N: | D. | CSO的电子式: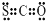 |
分析 A.F-的最外层含有8个电子;
B.二氧化碳为直线型结构,碳原子半径大于氧原子半径;
C.结构式中不能有电子;
D.CSO属于共价化合物,C与O、S分别形成2个共用电子对.
解答 解:A.F-的最外层含有8个电子,F-的结构示意图: ,故A错误;
,故A错误;
B.二氧化碳为直线型结构,碳原子半径大于氧原子半径,则CO2的分子模型示意图: ,故B错误;
,故B错误;
C.结构式中不能有电子,N2的结构式:N≡N,故C错误;
D.CSO属于共价化合物,C与O、S分别形成2个共用电子对,则CSO的电子式: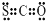 ,故D正确.
,故D正确.
故选D.
点评 本题考查了化学用语的判断,属于基础知识的考查,题目难度不大,注意掌握常见物质的表示方法,试题考查了学生规范答题的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 ;粒子E的名称是水合氢离子;粒子F对应的元素在周期表中的位置是第三周期、ⅢA族.
;粒子E的名称是水合氢离子;粒子F对应的元素在周期表中的位置是第三周期、ⅢA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑤⑥ | C. | ③ | D. | ②④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
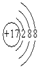

 ,化合物中含有离子键键(填离子或共价)
,化合物中含有离子键键(填离子或共价)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA | |
| B. | 将含有0.1molFeCl3的饱和溶液滴入沸水中,产生胶粒的数目为0.1NA | |
| C. | 1molC7H16中含有共价键的数目为23NA | |
| D. | 常温下,1L 0.1 mol•L-1的Na2CO3溶液中含有的离子总数为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com