
| A. | Fe3+ (Al3+),加过量的氨水,过滤 | |
| B. | KCl溶液(BaCl2),加入足量的K2SO4溶液,过滤 | |
| C. | CO2 (SO2),将混合气体通过依次饱和碳酸氢钠溶液和浓硫酸,洗气 | |
| D. | NaHCO3溶液(Na2CO3溶液):加入适量的Ca(OH)2溶液,过滤 |
分析 A.二者均与氨水反应生成沉淀;
B.氯化钡与硫酸钾反应生成沉淀和KCl,硫酸钾足量;
C.二氧化硫与碳酸氢钠反应生成二氧化碳,浓硫酸可干燥气体;
D.二者均与氢氧化钙反应.
解答 解:A.二者均与氨水反应生成沉淀,不能除杂,应先加足量NaOH、过滤,向沉淀中加酸即可,故A错误;
B.氯化钡与硫酸钾反应生成沉淀和KCl,硫酸钾足量,引入新杂质,应加适量,故B错误;
C.二氧化硫与碳酸氢钠反应生成二氧化碳,浓硫酸可干燥气体,则依次饱和碳酸氢钠溶液和浓硫酸,洗气可除杂,故C正确;
D.二者均与氢氧化钙反应,应选氯化钙除杂,故D错误;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应及混合物分离提纯方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:解答题
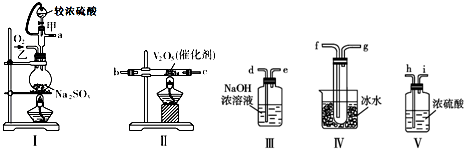
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
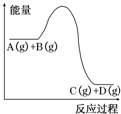
| A. | 加入催化剂时,该反应的反应热发生改变 | |
| B. | 升高温度,利于A的转化率增大 | |
| C. | 该反应的正反应为放热反应 | |
| D. | 增大压强,能够加快反应达到平衡状态的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2SO4溶液中混有少量CuSO4的杂质可用适量的KOH除去 | |
| B. | Na2CO3固体中含有少量NaHCO3杂质可用加热的方法提纯 | |
| C. | Fe(NO3)3中混有少量Fe(NO3)2的杂质可加入适量的氯水除去 | |
| D. | 可以用分液的方法分离CCl4和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40mL 0.5mol•L-1 NaCl溶液 | B. | 10 mL 0.3 mol•L-1Na2SO4溶液 | ||
| C. | 50mL 0.4 mol•L-1 NaOH溶液 | D. | 20mL 0.15 mol•L-1 Na3PO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2完全转化为SO3 | |
| B. | SO2、O2、SO3同时存在 | |
| C. | SO2、O2与SO3的浓度不再随时间变化 | |
| D. | SO2、O2与SO3的物质的量之比为2:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若c1=2c2,则w1<2w2,V<50 mL | B. | 若c1=2c2,则w1<2w2,V>50 mL | ||
| C. | 若w1=2w2,则c1<2c2,V=50 mL | D. | 若w1=2w2,则c1>2c2,V<50 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com