
【题目】控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置图 |
|
|
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | B中产生白色沉淀,C中溶液颜色褪去 | 试管中液体变浑浊 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | 硫酸亚铁铵分解的产物中除NH3外还含有SO3 和SO2 | 非金属性:C>Si |
A.AB.BC.CD.D
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示0.2mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
B. 图2表示用0.1000mo1· L—1NaOH溶液滴定25.00mLCH3COOH的滴定曲线,则c(CH3COOH)=0.100 mo1· L—1
C. 图3表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH
D. 图4表示恒温恒容条件下,2NO2(g) ![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,用浓度为
时,用浓度为![]() 的NaOH溶液滴定
的NaOH溶液滴定![]() 浓度均为
浓度均为![]() 的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是
的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是![]()

A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:![]()
B.用NaOH溶液滴定HY,当![]() 时溶液中
时溶液中![]()
C.用NaOH溶液滴定HY,当![]() 时溶液中
时溶液中![]()
D.当三种酸均滴定至![]() 时,HZ所用NaOH溶液体积最小
时,HZ所用NaOH溶液体积最小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图所示,下列说法正确的是( )

A.化合物甲、乙均为手性分子
B.化合物甲中最多有8个原子共平面
C.化合物乙中采取sp3杂化的原子只有N、C
D.化合物甲的沸点明显高于化合物乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下图所示的四个原电池装置,其中结论正确的是
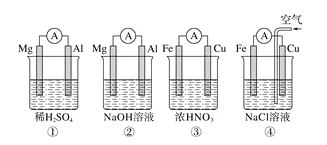
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为![]()
C.③中Fe作负极,电极反应式为![]()
D.④中Cu作正极,电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
已知:N2H4·H2O高温易分解,易氧化
制备原理:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
(实验一) 制备NaClO溶液(实验装置如图所示)

(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有_____(填标号)
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应化学程式是_____________________________。
(实验二) 制取水合肼。(实验装置如图所示)
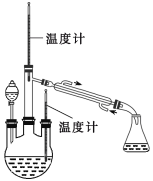
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114馏分。
(3)分液漏斗中的溶液是____________(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是____________。蒸馏时需要减压,原因是______________。
(实验三) 测定馏分中肼含量。
(4)水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体(保证滴定过程中溶液的pH保持在6.5左右),配制1000mL溶液。
b.移取10.00 mL于锥形瓶中,加入10mL水,摇匀。
c.用0.2000mol/L碘溶液滴定至溶液出现______________,记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(5)滴定时,碘的标准溶液盛放在______________滴定管中(选填:“酸式”或“碱式”)水合肼与碘溶液反应的化学方程式________________________。
(6)若本次滴定消耗碘的标准溶液为8.20mL,馏分中水合肼(N2H4·H2O)的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
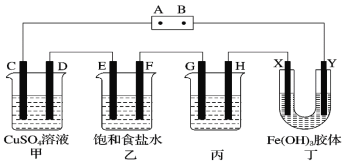
(1)电源A极的名称是________。
(2)甲装置中电解反应的总化学方程式为(电解质溶液是足量的):_______电解后若使电解质溶液复原需要加入适量的__________________
(3)如果收集乙装置中产生的气体,两种气体的体积比是(忽略气体的溶解)________。ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂。制备ClO2的新工艺是电解法。若调控合适的电压可以利用乙装置制备ClO2,写出阳极产生ClO2的电极反应式__________ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂污水中含CN-,现用ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:_____________。
(4)欲用丙装置给铜镀银,G应该是________(填“铜”或“银”),电镀液的主要成分是________(填化学式)。
(5)装置丁中的现象是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置可以模拟铁的电化学防护。下列说法不正确的是 ( )
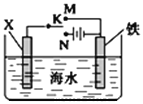
A.若X为碳棒,开关K置于N处,为外加电源的阴极保护法,可减缓铁的腐蚀
B.若X为碳棒,开关K置于N处,X极发生氧化反应
C.若X为锌棒,开关K置于M处,为牺牲阳极的阴极保护法,可减缓铁的腐蚀
D.若X为锌棒,开关K置于M处,铁极发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com