
分析 (1)煤、石油、天然气是化石燃料,太阳能、核能、地热能、潮汐能、风能、氢能、生物质能等都是新能源;
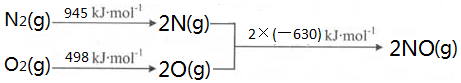
(2)①根据能量变化图计算反应热,反应热=吸收的能量-放出的能量,再根据热化学反应方程式的书写规则书写;
②温度升高,平衡向吸热方向移动;
(3)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式,利用盖斯定律书写该反应的热化学方程式,据此计算.
解答 解:(1)煤、石油、天然气是化石能源,能引起严重的空气污染,不是新能源.常见新能源有:太阳能、核能、地热能、潮汐能、风能、氢能、生物质能等,这些能源对环境污染小,属于对环境友好型能源,
故答案为:B;
(2)①该反应中的反应热=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,所以其热化学反应方程式为:N2(g)+O2(g)=2NO(g)△H=+183 kJ•moL-1,
故答案为:N2(g)+O2(g)=2NO(g)△H=+183 kJ•moL-1;
②温度升高,平衡向吸热方向移动,化学平衡常数增大,
故答案为:增大;
(3)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式:
①O2(g)+2H2(g)=2H2O(L)△H=-571.6kJ•mol -1;
②CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=-890.2kJ•mol-1;
③2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1,
利用盖斯定律将②-①-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.4kJ•mol -1,
即生成2molCO,需要吸热247.4KJ,故生成1molCO,需要吸热$\frac{1}{2}×$247.4KJ=)123.7kJ,
故答案为:123.7kJ.
点评 本题涉及热化学反应方程式、化学平衡常数、未来新能源标准等,注意反应热的计算方法,为易错点,难度中等.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. ,它能与双氧水在酸性条件下反应,生成两种无毒气体,其离子方程式为2CN-+5H2O2+2H+═N2↑+2CO2↑+6H2O.
,它能与双氧水在酸性条件下反应,生成两种无毒气体,其离子方程式为2CN-+5H2O2+2H+═N2↑+2CO2↑+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ•mol-1 | a | b | c | x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时Li+由正极向负极移动 | |
| B. | M可能为羧酸、醇等含活泼氢的有机物 | |
| C. | 充电时的阳极反应为LixC-xe-=C+xLi+ | |
| D. | 钾离子电池的比能量(单位质量释放的能量)低 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com