
不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,x越大,其原子吸引电子的能力越强。下面是某些短周期元素的x值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
(1)通过分析x值变化规律,确定Mg的x值范围:____<x(Mg)<________。
(2)推测x值与原子半径的关系是________________________________________;
根据短周期元素的x值变化特点,体现了元素性质的________________变化规律。
(3)分别指出下列两种化合物中氧元素的化合价:HClO________,HFO________。
(4)经验规律告诉我们:成键的两原子相应元素x数值的差值为Δx,当Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键类型是________________。
(5)预测元素周期表中,x值最小的元素位于第________周期第________族(放射性元素除外)。
答案 (1)0.9 1.5 (2)同周期(同主族)中,x值越大,其原子半径越小 周期性 (3)-2 0 (4)共价键 (5)第6 第ⅠA
解析 (1)x代表电负性的大小,根据位置关系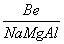 判断x(Na)<x(Mg)<x(Be),即0.9<x(Mg)<1.5。
判断x(Na)<x(Mg)<x(Be),即0.9<x(Mg)<1.5。
(2)x值越大,其原子半径越小,电负性随着原子序数的递增,呈现周期性变化。
(3)根据电负性的数值,在HClO中氧为-2价,根据
H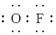 ,H和O的共用电子对偏向O,而O和F的共用电子对又偏向F,所以O为0价。
,H和O的共用电子对偏向O,而O和F的共用电子对又偏向F,所以O为0价。
(4)x(Br)-x(Al)<x(Cl)-x(Al)=3.0-1.5=1.5,所以AlBr3中化学键类型为共价键。
(5)电负性最小的应为金属性最强的。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
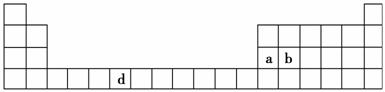
(1)请写出元素d的基态原子电子排布式________________________________________________________________________。
(2)b元素的氧化物中b与氧元素之间的共价键类型是________。其中b原子的杂化方式是________。
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
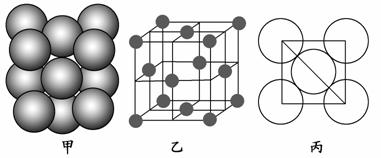
若已知a的原子半径为d,NA代表阿伏加德罗常数,a的相对原子质量为Mr,则一个晶胞中a原子的数目为________,该晶体的密度为________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组原子中,化学性质一定相似的是 ( )
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p轨道上只有2个电子的X原子与3p轨道上只有2个电子的Y原子
D.最外层都只有一个电子的X、Y原子
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 g氢气完全燃烧生成液态水时放出热量143 kJ,18 g水蒸气变成液态水放出44 kJ的热量。其他相关数据如下表:
| O===O(g) | H—H | H—O | |
| 1 mol化学键断裂时需要吸收的能量/kJ | 496 | x | 463 |
则表中x为( )
A.920 B.557
C.436 D.188
查看答案和解析>>
科目:高中化学 来源: 题型:
能源问题是现代社会发展的三大基本问题之一,能源家族中:①煤炭、②核能、③石油、④天然气、⑤水能、⑥风能、⑦地热能等,属于不可再生的是________(填序号,下同);属于新能源的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
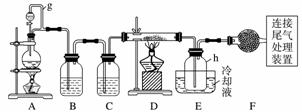
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:________________________________________________________________________。
(2)装置A中g管的作用是____________;装置C中的试剂是__________;装置E中的h瓶需要冷却的理由是_______________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是______________________(填写元素符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com