
| A、所含原子数一定相等 |
| B、物质的量一定相等 |
| C、质量一定相等 |
| D、密度一定相等 |
| V |
| Vm |
| N |
| NA |
| m |
| M |
| M |
| Vm |
| V |
| Vm |
| M |
| Vm |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、46g NO2气体中含有的分子数一定为NA |
| B、1molCH3+(碳正离子)中含有电子数为10NA |
| C、1mol铜与足量硫蒸气反应,转移电子数为2NA |
| D、1mol Mg与足量O2或N2反应生成MgO或Mg3N2,均失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne原子的核外电子数相差1,Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne原子的核外电子数相差1,Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强.下列说法正确的是( )| A、对应简单离子半径:X>W |
| B、对应气态氢化物的稳定性Y>Z |
| C、化合物XZW既含离子键,又含共价键 |
| D、Y的氧化物与Z的氧化物和X的最高价氧化物对应的水化物均能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质:水银、石墨、氦气、HD |
| B、氧化物:金刚砂、Na2O2、双氧水、N2O4 |
| C、混合物:水玻璃、盐酸、胆矾、AgI胶体 |
| D、盐:碱式碳酸铜、小苏打、KI,Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 仪器 | 试剂 | 加入该试剂的目的 |
| A | 鼓入空气时洗去CO2 | |
| B | 使样品充分反应放出气体 | |
| C | a | |
| D | e | 充分吸收CO2 |
| E | e |
查看答案和解析>>
科目:高中化学 来源: 题型:
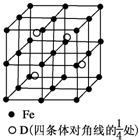 A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.
A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com