
【题目】从海水中得到的粗食盐水中常含Ca2+、Mg2+、SO42—,需要分离提纯。现有含少量CaCl2、MgCl2、Na2SO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂:①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中的Ca2+、Mg2+、SO42—。提纯时的操作步骤和加入试剂的情况如图。
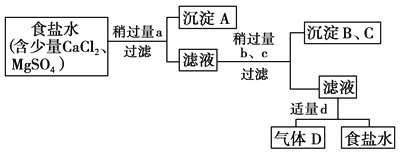
图中a、b、c、d分别表示上述4种试剂中的一种。若a为BaCl2溶液,请回答:
(1)沉淀A的是________。(填化学式)
(2)过滤操作需要的玻璃仪器有___________________________。
(3)试剂d是________;判断试剂d已经过量的方法是:________________________。
(4)加入b、c后溶液中发生的化学反应的化学方程式有:MgCl2 + 2NaOH == Mg(OH)2 ↓ + 2NaCl;
____________________________________________ ;_________________________________。
(5)检验粗食盐水中含有SO42—的方法是___________________________________________________。
【答案】硫酸钡漏斗、玻璃棒、烧杯盐酸溶液中不会再产生气体Na2CO3+CaCl2=CaCO3↓+2NaCl Na2CO3+BaCl2=BaCO3↓+2NaCl用干净的试管取上层清液,向试管中滴加BaCl2溶液,若有沉淀生成说明含有SO42—
【解析】
根据镁离子会与氢氧根离子和碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀,加入盐酸可以除去过量的碳酸钠和氢氧化钠。
(1)根据加入的试剂确定沉淀的成分;
(2)根据过滤实验用到的仪器以及常见仪器的名称来回答;
(3)根据盐酸可以和碳酸根离子之间的反应来回答;
(4)根据试剂碳酸钠和氢氧化钠的作用分析发生的反应;
(5)根据SO42—的检验方法分析。
镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都行;钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀;但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡。离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,
(1)4种试剂①盐酸;②Na2CO3;③NaOH;④BaCl2来除去食盐水中Ca2+、Mg2+、SO42-,加入试剂的顺序是④③②①,氯化钡可以将硫酸根离子沉淀,所以沉淀A是硫酸钡,
故答案为:硫酸钡;
(2)过滤实验用到的仪器:漏斗、玻璃棒、烧杯等,
故答案为:漏斗、玻璃棒、烧杯;
(3)试剂d是盐酸,盐酸可以和碳酸根离子之间反应生成水以及二氧化碳,当不再产生二氧化碳时,证明盐酸已经过量,
故答案为:盐酸;溶液中不会再产生气体;
(4)根据以上分析,a为BaCl2溶液,d是盐酸,则b、c为氢氧化钠溶液或碳酸钠溶液。氢氧化钠能和氯化镁生成氢氧化镁和氯化钠,反应的化学方程式为:2NaOH+MgCl2═Mg(OH)2↓+2NaCl,碳酸钠溶液分别和氯化钙、氯化钡溶液反应为:Na2CO3+CaCl2=CaCO3↓+2NaCl,Na2CO3+BaCl2=BaCO3↓+2NaCl,
故答案为:Na2CO3+CaCl2=CaCO3↓+2NaCl;Na2CO3+BaCl2=BaCO3↓+2NaCl;
(5)检验粗食盐水中含有SO42—的方法是用干净的试管取上层清液,向试管中滴加BaCl2溶液,若有沉淀生成说明含有SO42—,
故答案为:用干净的试管取上层清液,向试管中滴加BaCl2溶液,若有沉淀生成说明含有SO42—。


科目:高中化学 来源: 题型:
【题目】下列框图给出了8种有机化合物的转化关系,请回答下列问题:
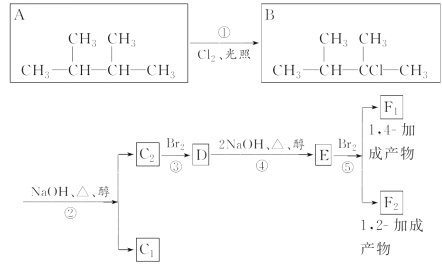
(1)根据系统命名法,化合物A的名称是________。
(2)上述框图中,①是________反应,③是________反应。(填反应类型)
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:___________________。
(4)C2的结构简式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18 mol·L-1 浓硫酸配制90 mL 3.0 mol·L-1 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积
②量取一定体积的浓硫酸
③溶解
④
⑤转移、洗涤
⑥定容、摇匀
⑦装瓶贴标签
完成下列问题:
(1)所需浓硫酸的体积是_____________,量取浓硫酸所用的量筒的规格是 _____________(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。浓硫酸稀释的操作______________。
(2)第④步实验的操作是_______________________________________________________
(3)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.用量筒量取浓硫酸后洗涤量筒并将洗涤液注入容量瓶内___________________;
B.容量瓶用蒸馏水洗涤后残留有少量的水________________;
C.所用过的烧杯、玻璃棒未洗涤________________;
D.定容时俯视刻度线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有四种化合物W、X、Y、Z,它们是由短周期元素A、B、C、D、E中的两种元素组成。已知
(1)A、B、C、D、E的原子序数依次增大,且A、D同主族,C、E同主族;B、C 同周期;
(2)W由A、B组成,其分子中原子个数比为A:B=4:1,常温为气态。
(3)X由A、C组成,其分子中原子数比为A:C=1:1
(4)Y是C、D形成的离子化合物,且Y晶体中相应元素的原子个数比为1:1
(5)Z是由D、E形成的离子化合物,其中阳离子比阴离子少一个电子层,阳离子数与阴离子数之比为2:1 则B为__________,W为_________,X的结构式________Y的电子式为______________。
II.(1).一元素原子的N层上只有1个电子,该元素原子各内层均已充满,写出该原子电子排布式:________________,
(2)一元素属于短周期元素,该元素的原子核外所有P轨道全满或者半满,写出该元素原子的价电子轨道排布图__________________,
(3)乙烯分子中有__________个σ键,___________π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示,不正确的是( )
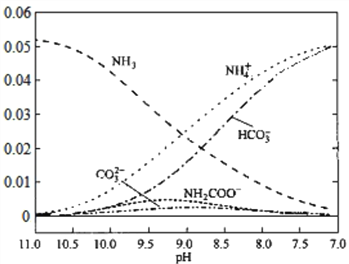
A. 在pH=9.0时,c(NH4+)>c(HCO3ˉ)>c(NH2COOˉ)>c(CO32-)
B. 在氨-水体系中不断通入CO2,体系中始终存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3ˉ)+c(OHˉ)
C. 随着CO2的通入,![]() 不断减小
不断减小
D. pH=7时,水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.玫瑰的香味物质中包含苧烯,苧烯的键线式为![]()
(1)写出苧烯跟等物质的量的Br2发生加成反应所得产物的可能的结构:________________________(用键线式表示)。
(2)有机物A是苧烯的同分异构体,分子中含有![]() 结构,A可能的结构有____种。
结构,A可能的结构有____种。
II.某烃键线式为![]() ,该烃与Br2以物质的量之比1: l加成时,所得产物有_______种。
,该烃与Br2以物质的量之比1: l加成时,所得产物有_______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配置100 mL 1.0×10-2 mol·L-1的CuSO4溶液,下列玻璃仪器中,一定要用到的有( )
A. 漏斗 B. 玻璃棒 C. 烧杯 D. 容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,下列操作或发生事故时的处理方法正确的是
A. 可用燃着的酒精灯引燃另一只酒精灯。
B. 给试管里的液体加热时,试管应与桌面垂直。
C. 配置一定浓度的NaCl溶液时,定容振荡摇匀后,发现液面低于刻度线,再加水到刻度线。
D. 浓硫酸不慎沾在皮肤上,应立即用大量水冲洗,最后涂上3%-5%的小苏打溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下列各图所示是中学化学中常用于混合物分离和提纯的装置:
A. 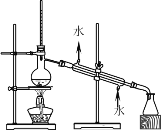 B.
B. 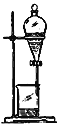
C.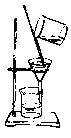 D.
D. 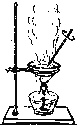
请根据装置图回答下列问题:
⑴A图中用于盛放液体混合物的仪器的名称为:__________________
⑵选择合适的实验装置分离以下混合物(填代表装置的字母),
①从碘水中分离出I2 : ___________
②进行酒精和水的分离: ___________
③二氧化锰和蔗糖溶液: ___________
⑶我国具有历史悠久的酒文化,请回答下列问题:
①要提高酒精的度数,可采用的方法是________________(填操作方法,下同)
②中药常常浸泡在美酒中制成药酒,你认为利用的方法是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com