
【题目】X、Y、Z、Q、R 是五种短周期元素,原子序数依次增大。X、Y 两元素最高正价与最低负价之和均为 0;Q 与 X 同主族;Z、R 分别是地壳中含量最高的非金属元素和金属元素。 请回答下列问题:
(1)Y 在元素周期表中的位置为_____。
(2)五种元素原子半径由大到小的顺序是(写元素符号)_____
(3)QX 的电子式为_____;QX 与水反应放出气体的化学方程式为_____
(4)X、Z 两元素所形成化合物的电子式为__________________
【答案】 第二周期第IVA族 Na>Al>C>O>H Na+[:H]‐ NaH+H2O=NaOH+H2↑ 
【解析】X、Y 两元素最高正价与最低负价之和均为0,则X、Y为H、C、Si中的两种,因为原子序数依次增大,所以X为H,Y为C。Q和X同族,Q为Na。Z、R 分别是地壳中含量最高的非金属元素和金属元素,Z为O,R为Al。
(1)Y为C在周期表的二周期第IVA族。
(2)同周期从左向右半径减小,同主族由上向下,半径增大,氢原子是半径最小的原子,所以顺序为:Na>Al>C>O>H。
(3)QX为NaH,这是一种离子化合物,所以电子式为Na+[:H]‐。NaH与水反应得到氢氧化钠和氢气,方程式为:NaH+H2O=NaOH+H2↑
(4)X、Z 两元素所形成化合物为H2O或H2O2,电子式为: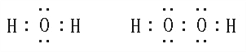 。
。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是
纯净物 | 混合物 | 电解质 | 酸性氧化物 | |
A | 高锰酸钾 | 空气 | 醋酸钠 | CO2 |
B | 硝酸 | 矿泉水 | 氯化铵 | H2S |
C | 盐酸 | 水银 | 纯碱 | Cl2O |
D | 氯化钠 | 豆浆 | 铜 | N2O5 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素在生物体内虽很少,却是维持正常生命活动不可缺少的,这可以通过下面哪一实例得到说明
A. Mg是叶绿素的组成成分 B. 油菜缺少硼时会出现“花而不实”
C. 动物血液钙盐含量太低会抽搐 D. 缺P会影响ATP的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分:
周期 族 | ||||||||
1 | ① | |||||||
2 | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | ||||
请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)画出元素②的离子结构示意图_________。
(2)②、③、⑤的离子半径由大到小的顺序为___________。
(3)元素④和⑥形成的化合物的电子式:_____________。
(4)元素②和⑤形成的化合物的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成分是MgO( 占40%,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2 等杂质,以此为原料制取的硫酸镁,可用于印染、选纸、医药等工业。从硼镁泥中提取MgSO4·7H2O 的流程如下:
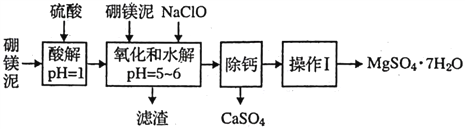
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸800mL,若用18.4mol/L的浓硫酸来配制,量取浓硫酸时,需使用的量筒的规格为______。
A.10mL B.20mL C.50mL D.100mL
(2)加入的NaClO可与Mn2+反应:Mn2+ +ClO-+H2O=MnO2 ↓+2H++Cl-,还有一种离子也会被NaClO 氧化,该反应的离子方程式为____________________。
(3)滤渣中除含有Fe(OH)3、A(OH)3 外还有_________________。
(4)在“除钙”前,需检验滤波中Fe3+是否被除尽,简述检验方法:_________。
(5)已知MeSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4 除去,根据上表数据,简要说明操作步骤: _________。“操怍I:是将滤液继续蒸发依缩,冷却结晶,______,便得到了MgSO4·7H2O。
(6)实验中提供的硼镁泥共100g,得到的MgSO4·7H2O为172.2 g,则MgSO4·7H2O的产率为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HNO2是一种弱酸,且不稳定,易分解生成 NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成 Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有 Fe2+。若误食亚硝酸盐(如NaNO2 ),则导致血红蛋白中的 Fe2+转化为 Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是_________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将 Fe3+还原为 Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,能用来区分NaNO2和NaCl的是_____(填序号)。
A.分别溶于水看溶解情况
B.在酸性条件下加入KI—淀粉溶液来区别
C.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和 HCl,请写出反应的离子方程式:____________________________________。
(4)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是______(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为 2∶1,试配平下列方程式:________________
![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将20 mL 0.5 mol/L Al2(SO4)3溶液加水稀释到500 mL,稀释后溶液中SO42﹣浓度为( )
A.0.01 mol/L
B.0.02 mol/L
C.0.03mol/L
D.0.06mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是
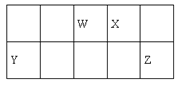
A. 氢化物热稳定性:W<X
B. 最高价氧化物对应水化物的酸性:W<Y
C. Z、W的氢化物的水溶液都呈酸性
D. 简单离子的半径:Y>Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com