
【题目】短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层有2个电子,Z单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是
A.原子半径由小到大的顺序为![]()
B.X的简单氢化物的热稳定性比W的强
C.化合物YX、![]() 、
、![]() 中化学键的类型相同
中化学键的类型相同
D.W的最高价氧化物对应水化物的酸性比Z的弱
【答案】B
【解析】
短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,故X原子有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,处于第ⅡA族,原子序数大于O元素,故Y为Mg元素,Z的单质常作为半导体材料,Z是Si元素。
A项、同主族元素自上而下,原子半径依次增大,故原子半径O<S,同周期元素自左而右,原子半径依次减小,故原子半径Mg>Si>S,则原子半径由小到大的顺序为Mg>Si>S>O,即X<W<Z<Y,故A错误;
B项、元素非金属性越强,简单氢化物的热稳定性越强,氧元素和硫元素为同主族元素,氧元素的非金属性强于硫元素,则氧元素的简单氢化物的热稳定性比硫元素的强,故B正确;
C项、氧化镁为离子化合物只含有离子键,二氧化硅和三氧化硫为共价化合物只含有共价键,化学键的类型不同,故C错误;
D项、元素非金属性越强,最高价氧化物对应水化物的酸性越强,硫元素和硅元素为同周期元素,硫元素的非金属性强于硅元素,则硫元素的最高价氧化物对应水化物的酸性比Z元素的强,故D错误;
故选B。


 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】现有短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍。下列说法正确的是
A.简单阳离子的氧化性:![]()
B.气态氢化物的沸点:![]()
C.X、Z与M不可能存在同一离子化合物中
D.Y2Z的溶液:c(Y+):c(Z2-) > 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )

A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g) H=+11 kJ·mol-1。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g) H=+11 kJ·mol-1。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
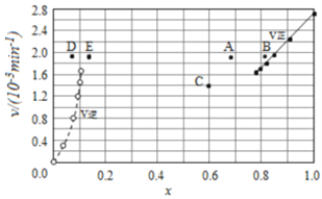
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当改变条件,再次达到平衡时,下列有关叙述不正确的是( )
A.若升高温度到某一温度,再次达到平衡时,相应点可能分别是A、E
B.若改变的条件是增大压强,再次达到平衡时,相应点与改变条件前相同
C.若改变的条件是使用催化剂,再次达到平衡时,相应点与改变条件前不同
D.若再次充入a mol HI,则达到平衡时,相应点的横坐标值不变,纵坐标值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是( )
A.原子序数:Y>X>Z>WB.离子半径:X+>Y2+>Z->W2-
C.原子最外层电子数:Z>W>Y>XD.还原性:X>Y,W2->Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=90.7 kJ·mol1
CH3OH(g) △H1=90.7 kJ·mol1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=23.5 kJ·mol1
CH3OCH3(g)+H2O(g) △H2=23.5 kJ·mol1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=41.2 kJ·mol1
CO2(g)+H2(g) △H3=41.2 kJ·mol1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=___________kJ·mol1。
CH3OCH3(g)+CO2(g)的△H=___________kJ·mol1。
(2)反应②达平衡后采取下列措施,能提高CH3OCH3产率的有___________。
A.加入CH3OH B.升高温度 C.增大压强 D.移出H2O E.使用催化剂
(3)以下说法能说明反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)达到平衡状态的有___________。
CH3OCH3(g)+CO2(g)达到平衡状态的有___________。
A.H2和CO2的浓度之比为3∶1
B.单位时间内断裂3个H—H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
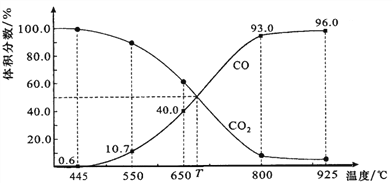
已知:气体分压(p分)=气体总压(p总)×体积分数。
①该反应△H_____0(填“>”、“<”或“=”),550 ℃时,平衡后若充入惰性气体,平衡__________(填“正移”、“逆移”或“不移动”)。
②650 ℃时,反应达平衡后CO2的转化率为_____________(保留2位有效数字)。
③T时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=_________p总。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用盐酸的质量分数为36.5%,密度为1.20 g·mL-1。
(1)此浓盐酸中HCl的物质的量浓度是________。
(2)配制100 mL该浓盐酸,需要标准状况下HCl的体积为________。
(3)配制100 mL 3.00 mol·L-1的盐酸,需以上浓盐酸的体积为________。
(4)将10.0 mL 3.00 mol·L-1的盐酸与10.0 mL 1.00 mol·L-1的MgCl2溶液混合,则混合溶液中Cl-的物质的量浓度是________。(设混合后溶液的体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究废旧电池的再利用,实验室利用旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示。下列叙述错误的是( )
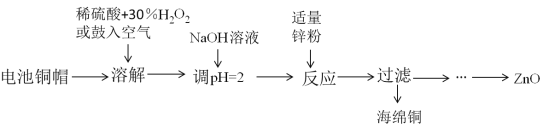
A.“溶解”操作中溶液温度不宜过高
B.铜帽溶解后,将溶液加热至沸腾以除去溶液中过量的氧气或H2O2
C.与锌粉反应的离子可能为Cu2+、H+
D.“过滤”后,将滤液蒸发结晶、过滤、洗涤、干燥后高温灼烧可得纯净的ZnO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa条件下,将15L O2通往10L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气体中,V(CO)=__________L,V(H2)=___________L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气中,V(CO): V(H2)=_______。
(3)若剩余气体的体积为a L,则a的取值范围是_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com