
【题目】2017年5月18日,中国国土资源部地质调查局宣布,我国在南海进行的可燃冰试采获得成功,成为全球第一个海域试采可燃冰成功的国家,可燃冰即天然气水合物,甲烷含量占80%至99.9%。化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇或合成氨,回答下列问题:
(1)甲醇是一种用途广泛的化工原料,工业上常用下列两种反应制备甲醇:
CO(g)+2H2(g)=CH3OH(g) △H1 =-90kJ·mol-1 K1
CO2(g)+3H2(g)= CH3OH(g)+H2O(l) △H2 K2
己知: CO(g)+H2O(g)= CO2(g)+H2(g) △H3 =-41.1kJ·mol-1 K3
H2O(l)=H2O(g) △H4 =+44.0kJ·mol-1 K4
则K2=_______ (用含K1、K3、K4的代数式表示)
(2)在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)十3H2(g) ![]() CH3OH(g)十H2O(g)
CH3OH(g)十H2O(g)
①下列能说明该反应已达到平衡状态的是______________________。
A.混合气体平均相对分子质量不变 B.混合气体密度不变
C.容器内压强恒定不变 D.反应速率满足以下关系:V正(CO2)=3V逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH-H键的同时形成2molH-O键
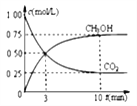
②模拟过程中测得CO2和CH3OH(g)浓度随时间变化如图所示,若此时容器内压强为P,则用平衡分压代替平衡浓度表示的化学平衡常数KP为_____________(用含P的代数式表示,数值保留两位小数),若此时再向容器内充入0.25molCO2和0.25molCH3OH的混合气体,则平衡______(填“正向“逆向“不”)移动。(已知:气体分压=气体总压×体积分数)
【答案】 K1/K3K4 A、C 33.33/P2 正向
【解析】(1)根据平衡常数的表达式可知K1=c(CH3OH)/c(CO)c2(H2);K2= c(CH3OH )/c(CO2)c3(H2); K3= c(CO2)c(H2)/c(CO)c(H2O); K4= c(H2O);通过以上整理可得:K2= K1/K4K3;正确答案:K1/K3K4。
(2) 该反应反应前后气体总质量不变,气体总量为减小的可逆反应,所以当混合气体平均相对分子质量不变时,反应达到平衡状态;A正确;该反应反应前后气体总质量不变,恒容密闭容器中,混合气体密度恒为定值,不能判定反应是否达到平衡状态;B错误;该反应为气体总量减小的反应,其他条件下不变,压强和气体的物质的量成正比,当容器内压强恒定不变,反应达到平衡状态;C正确;速率之比和系数成正比,3V(CO2)=V(H2),满足3V正(CO2)=V逆(H2)反应达到平衡状态,D错误;CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1为反应的一种特殊情况,不能判定反应是否达平衡状态,E错误;单位时间内断裂3NAH-H键,是正向速率,同时形成2molH-O键,也是正向速率,不能判定反应达到平衡状态;F错误;正确选项A、C 。
②根据图像可知:容器的体积为1L,根据方程式进行如下计算:
CO2(g) 十 3H2(g) CH3OH(g) 十 H2O(g)
起始量 1 3 0 0
变化量 0.75 2.25 0.75 0.75
平衡量 0.25 0.75 0.75 0.75
平衡分压 0.1P 0.3 P 0.3 P 0.3 P
所以化学平衡常数KP为P(CH3OH)×P(H2O)/P(CO2)×P3(H2) ;P(CH3OH)×P(H2O)=0.3 P×0.3 P=0.09 P2 ,P(CO2)×P3(H2)=0.1 P×(0.3 P)3=0.0027 P4;KP为0.09 P2/0.0027 P4=33.33/P2;若此时再向容器内充入0.25molCO2和0.25molCH3OH的混合气体,则浓度商Qp= P(CH3OH)×P(H2O)/ P(CO2)×P3(H2);这时,各物质分压分别为:P(CH3OH)=1/3 P, P(H2O)=0.25 P, P(CO2)=1/6 P, P(H2)=0.25 P;把数据带入Qp=32/p2<33.33/P2=KP,所以平衡正向移动;正确答案:33.33/P2 ;正向。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.NaHCO3、CH4均含有离子键和共价键
B.晶体氦He中既无化学键又无分子间作用力
C.只含有共价键的物质是共价化合物
D.原子最外层电子数为5的元素一定是ⅤA族的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】273K、101kPa下,2.8g N2、1.6g O2和2g Ar混合气体的密度是
A. 1.43 g/L B. 1.83 g/L
C. 1.83 mg/L D. 1.43 mg/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中发生反应:xA(g) +B(g)![]() 2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是
2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是
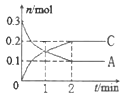
A. x=1
B. 反应进行到1min时,反应体系达到化学平衡状态
C. 2min后,A的正反应速率一定等于C的逆反应速率
D. 2min后,容器中A与B的物质的量之比一定为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾的化学式为K4Fe(CN)6,一种用含NaCN废水合成该化合物的主要工艺流程如下:

(1)请依据工艺流程图中的信息,回答下列问题:
①在“除杂”步骤中弃渣的主要成分为__________________(填化学式)。
②在“反应器“中发生的主要反应的化学方程式为:________________________________;
③相同温度下溶解度:Na4[Fe(CN)6]________K4[Fe(CN)6] (选填“>”、“<”或“=”)
(2)氰化钠(NaCN)是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。NaCN 的电子式为__________________________;实验室用NaCN固体配制NaCN溶液时,应先将其溶于氢氧化钠溶液中,再用蒸馏水稀释。NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是______________________________________。
(3)已知:氢氰酸是一种有苦杏仁气味的无色剧毒液体,易挥发,25℃时,Ka(HCN)=6.25×10-10。
①处理含CN-废水的方法是:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN-;第二步控制pH为7.5-8.5,用NaClO完全氧化OCN-生成N2和两种盐。
请写出第二步反应的离子方程式:_________________________________________。
②反应CN-+H2O![]() HCN+OH-在25℃时的平衡常数K=_____________(填数值)。
HCN+OH-在25℃时的平衡常数K=_____________(填数值)。
(4)K4Fe(CN)6与高锰酸钾溶液反应,其方程式为:
K4Fe(CN)6+KMnO4 +H2SO4=KHSO4+Fe2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平), 若有1mol K4Fe(CN)6被高锰酸钾氧化时,则消耗KMnO4的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.根据下列各题中所给出的数据,可分别求出其溶液的“溶质质量分数”或溶液的“物质的量浓度”,试求解。
(1)已知某氢氧化钠溶液V L中含有N个氢氧根离子,可求出此溶液的物质的量浓度是________。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液的溶质的质量分数为________。
Ⅱ.常温下,10.0 mL 1.0 mol·L-1的H2SO4(aq),加水稀释到500 mL,所得H2SO4(aq)的浓度为________mol·L-1;蒸发浓缩,使溶液的体积为2.40 mL,所得H2SO4(aq)的浓度为____mol·L-1。
Ⅲ.已知标准状况下1体积水能溶解500体积的氯化氢,得到密度为1.19g/mL的盐酸,则可求出标准状况下氯化氢饱和溶液中溶质的质量分数为______,该盐酸的浓度为_____(结果均保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列三个反应,判断物质的氧化性由强到弱的顺序正确的是( )
①2Fe3++2I-===2Fe2++I2
②2Fe2++Cl2===2Fe3++2Cl-
③2MnO![]() +10Cl-+16H+===2Mn2++5Cl2↑+8H2O
+10Cl-+16H+===2Mn2++5Cl2↑+8H2O
A. Fe3+>Cl2>MnO![]() B. Fe3+>Cl2>I2 C. I2>Cl2>Fe3+ D. MnO
B. Fe3+>Cl2>I2 C. I2>Cl2>Fe3+ D. MnO![]() >Cl2>Fe3+
>Cl2>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所示的体检报告的部分项目中,表示总胆固醇指标的物理量是( )
送检物:血液 检验目的:血常规 血型:O型 | 检验结果: 项目中文名称结果单位参考值 ALT谷丙转氨酶7U/L<40 ALB白蛋白43.9g/L35-55 TC总胆固醇4.27mmol/L3.6-5.18 |
A.溶解度B.质量分数C.密度D.物质的量浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com